Пропан
| Пропан | |
 | |
| Маса | 7,3E−26 кг[1] |
|---|---|
| Небезпечність місцевості | propane exposured |
| Хімічна формула | C₃H₈[1] |
| Канонічна формула SMILES | CCC[1] |
| Енергія іонізації | 11,07 ± 0,01 електронвольт[2] і 1,8E−18 джоуль[3] |
| Дипольний момент | 2,8E−31 coulomb metre[3] |
| Стандартна ентальпія утворення | −104 680 джоуль на моль[4] |
| Стандартна молярна ентропія | 269,9 ± 0,05 Дж / (моль·К)[5] |
| Температура плавлення | −306 ± 1 ℉[2] і −187,69 °C[3] |
| Точка кипіння | −44 ± 1 ℉[2], 231,1 K[4] і −42,1 °C[3] |
| Тиск насиченої пари | 8,4 ± 0,1 атмосфера[2] |
| Швидкість звуку | 1158 ± 1 метр на секунду[6] |
| Розчинність | 0,01 ± 0,01 g/100 g[2] |
| Нижня межа займання | 2,1 ± 0,1 % (V/V)[2] |
| Верхня межа займання | 9,5 ± 0,1 % (V/V)[2] |
| Класифікація та маркування безпеки | NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response[d] |
| Ідентифікатор PGCH | 0524 |
| Часове середнє значення межі допустимого впливу | 1800 ± 1 mg/m³[2] |
| IDLH | 3780 ± 10 mg/m³[2] |
| Наявний у таксона | C. officinalis[7][7][8] |
| Внормовано | A3[d][9] |
| | |
Пропа́н — безбарвний газ, tкип = -42,07 °С. Формула: СН3СН2СН3. Міститься у природних і нафтових газах, утворюється під час крекінгу нафтопродуктів.
Як і етан, пропан у чистому вигляді в природі не трапляється, але є обов'язковою складовою супутнього газу нафтових покладів.
Застосовується для одержання пропілену, нітрометану, технічного вуглецю тощо. Використовується як автомобільне паливо, розчинник, побутовий газ (у суміші з бутаном).
Цей розділ потребує доповнення. |
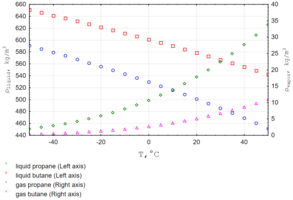
Маса 1 м³ пропану за нормальних умов дорівнює 1,9659 кг. Густина пропану суттєво залежить від температури.[10]
-
Залежність густини рідкого та газоподібного пропану від температури
Теплота згоряння пропану — від 86,5 до 93,9 МДж/м³. Температура самозаймання 466 °С. Концентраційна границя вибуховості 2,1-9,5 %.
Цей розділ потребує доповнення. |
1. Окиснення
Пропан вступає в реакцію горіння подібно до інших алканів. В присутності надлишку кисню пропан горить з утворенням води та діоксиду вуглецю.
При недостатній кількості кисню для повного згоряння також утворюються монооксид вуглецю, сажа (вуглець) або обидві речовини:
2. Галогенування
2.1. Хлорування.
При термічному хлоруванні пропану масовий вихід 1-хлорпропану складає — 75 %, 2-хлорпропану — 25 %
При фотохімічному хлоруванні пропану масовий вихід 1-хлорпропану складає 43 %, 2-хлорпропану 57 %
2.2. Бромування. Бромування перебігає повільніше, ніж хлорування, а значить селективні, тобто з утворенням переважно одного продукту. Так, при фотохімічному бромуванні пропану утворюється переважно 2-бромпропан (92 %)

Пропан товарний — рідина, що містить не менше 93 % пропану чи пропілену, пружність пари якої при 45 °С не перевищує 1,6 МПа. Вміст бутанів-бутиленів допускається до 3 %, етану-етилену (до 4 %) обмежується максимальним тиском парів. Корозійна активність, вміст сірки, вологи і густина товарного пропану регламентуються технічними умовами на його постачання. Якщо пропан використовується як моторне паливо, то обмежується допустимий вміст пропілену. Рідинний залишок при -20 °С обмежується 2 %, вміст сірководню — 50 мг/м³ газу.

Пропан-бутанова суміш товарна — рідина, яка містить етан-етилену до 4 %, пентанів до 3 %, сірководню до 50 мг/м³ газу. Пружність пари за температури 45 °С не повинна перевищувати пружність пари пропану (див. пропан товарний). Температура випаровування (об'ємна частка 95 %) повинна бути рівною температурі випаровування бутану. Склад суміші (скрапленого газу), яка використовується як паливо для комунально-побутового споживання, обмежується пружністю пари 1,6 МПа за температури 45 °С. При цьому забезпечується достатня леткість газового палива.
Зареєстрований як харчова добавка E944.[11]
- ↑ а б в PROPANE
- ↑ а б в г д е ж и к http://www.cdc.gov/niosh/npg/npgd0524.html
- ↑ а б в г David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ а б Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics // J. Chem. Educ. — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_ChemPRIME_(Moore_et_al.)/16%3A_Entropy_and_Spontaneous_Reactions/16.06%3A_Standard_Molar_Entropies
- ↑ CRC Handbook of Chemistry and Physics / David R. Lide, Jr. — 78 — USA: CRC Press, 1997. — P. 14–37. — ISBN 978-0-8493-0478-1
- ↑ а б Wiłkomirski B. Pentacyclic triterpene triols from calendula officinalis flowers // Phytochemistry — Elsevier BV, 2002. — Vol. 24, Iss. 12. — P. 3066–3067. — 2 p. — ISSN 0031-9422; 1873-3700 — doi:10.1016/0031-9422(85)80062-5
- ↑ B Wilkomirski Pentacyclic triterpene triols from calendula officinalis flowers // Phytochemistry — Elsevier BV, 1985. — Vol. 23, Iss. 12. — P. 3066–3067. — 2 p. — ISSN 0031-9422; 1873-3700 — doi:10.1016/S0031-9422(00)80640-8
- ↑ https://www.bfs-kaelte-klima.de/fileadmin/DATEIEN/Download/Einlegeblatt_fuer_die_Betriebshandbuecher-Broschuerendruck.pdf
- ↑ Зівенко, Олексій (2019). ОСОБЛИВОСТІ ОБЛІКУ СКРАПЛЕНОГО ВУГЛЕВОДНЕВОГО ГАЗУ ПІД ЧАС ЗБЕРІГАННЯ ТА ТРАНСПОРТУВАННЯ. Вимірювальна техніка та метрологія. Т. 80, № 3. с. 21—27. doi:10.23939/istcmtm2019.03.021. ISSN 0368-6418. Процитовано 16 листопада 2021.
- ↑ Approved additives and E numbers | Food Standards Agency. www.food.gov.uk (англ.). Процитовано 26 вересня 2024.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Бойко В. С., Бойко Р. В. Тлумачно-термінологічний словник-довідник з нафти і газу. Тт. 1-2, 2004—2006 рр. 560 + 800 с.
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |