Ізотопи

По горизонталі — кількість протонів (заряд ядра).
По вертикалі — кількість нейтронів.
Колір — стабільність ізотопу (тривалість напіврозпаду).
Ізото́пи — нукліди одного і того самого хімічного елементу, які мають різну кількість нейтронів, а, отже, різне масове число і різну атомну масу.
Ізотопи позначають тими самими символами, що й хімічний елемент, додаючи зверху з лівого боку символу масове число, наприклад, ізотопи хлору позначають: 35Cl і 37Cl, або масове число подають після назви чи символу елементу, наприклад: уран-233 чи Pu-239.
Ізотопи одного хімічного елемента мають однаковий заряд атомного ядра, тобто один порядковий номер, і займають те ж саме місце в періодичній системі, мають однакову кількість протонів в ядрі атома, але відрізняються один від одного кількістю нейтронів. Так, в атомному ядрі ізотопу хлору 35Cl міститься 17 протонів, оскільки порядковий номер хлору 17, і 18 нейтронів (35-17=18), а в ядрі ізотопу хлору 37Cl — 17 протонів і 20 нейтронів (37-17 = 20).
Деякі хімічні елементи мають невелику кількість стабільних ізотопів. Так, для кисню відомо три стабільні ізотопи: 16O (ядро складається з 8 протонів і 8 нейтронів), 17O (ядро складається з 8 протонів і 9 нейтронів) і 18О (ядро складається з 8 протонів і 10 нейтронів). Для водню відомо теж три ізотопи: 1H (ядро складається лише з одного протона), 2H (ядро складається з одного протона і одного нейтрона), 3H (ядро складається з одного протона і двох нейтронів). Деякі ж хімічні елементи складаються з досить великої кількості ізотопів. Наприклад, ксенон має 9 ізотопів у природній суміші, олово — 10 і т. д.; для цих елементів також відомі десятки штучних радіоактивних ізотопів.
Переважна більшість ізотопів не має спеціальних назв, але для ізотопів деяких елементів, зокрема для ізотопів водню, існують спеціальні назви і навіть спеціальні символи. Так, ізотоп водню 1H називають протій, ізотоп 2H — дейтерій і позначають символом D, а ізотоп 3Н — тритій (символ T).
Деякі ізотопи в природі досить поширені, як, наприклад, ізотоп кисню 16O та ізотоп водню 1Н, а інші ізотопи зустрічаються в дуже мізерних кількостях, як ізотопи кисню 17O і 18O і ізотопи водню 2H і 3H.
За хімічними властивостями всі ізотопи окремого елементу дуже близькі, тому значної різниці між ними у хімічних реакціях не спостерігається. Виняток становлять лише ізотопи водню, які за своїми властивостями помітно відрізняються один від одного.
Атомна маса ізотопу виражена у вуглецевих одиницях і не є цілим числом для всіх елементів окрім С-12, на відміну від масового числа, яке є завжди цілим числом, рівним сумі протонів та нейтронів.

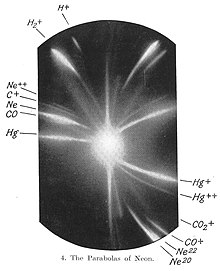
До 20 століття загальноприйнятою була думка, що атомна маса елементу є його постійною і незмінною характеристикою. Проте, з відкриттям наприкінці 19 століття радіоактивних речовин, це уявлення почало змінюватися.
Під час радіоактивного розпаду утворювалися елементи, що, через їх різну атомну масу, вважали різними, і давали їм окремі назви. У 1910 році Фредерік Содді показав, що мезоторій (тодішня назва радію-228), радій (радій-226, довгоживучий ізотоп, що зустрічається в природі) і торій-X (радій-224) хімічно нероздільні. А в 1913 році він же показав, що під час розпадів радіоактивних речовин на проміжку від урану до свинцю утворюється близько 40 радіоелементів з різною масою, тоді як у таблиці Менделєєва між цими елементами може розміщуватись не більш як 11 інших.
Того самого року Содді й Казимір Фаянс запропонували закон радіоактивних зміщень, згідно з яким альфа-розпад зміщує елемент у таблиці на дві позиції вліво, зменшуючи його масу на 4, тоді як бета-розпад — на одну позицію вправо, залишаючи масу незмінною. Таким чином, альфа-розпад, що супроводжується двома бета-розпадами, породжує елемент, що не відрізняється від материнського хімічно, проте має меншу атомну масу.
Сам термін "ізотоп", що з грецької можна перекласти як "в тому самому місці", Содді підказала шотландський фізик Маргарет Тодд під час бесіди, у якій той поділився з нею своїми ідеями.[1]
Пізніше були відкрито, що деякі нерадіоактивні елементи є сумішшю кількох стабільних ізотопів. Першим елементом, для якого були відкриті такі ізотопи був неон: у 1913 році Джозеф Томпсон показав, що у природному неоні присутні дві фракції з атомними масами 20 і 22. З розвитком мас-спектрометрії виявляти такі ізотопи стало простіше. У 1919 році Френсіс Астон відкрив велику кількість елементів, що мають кілька стабільних ізотопів. Крім того, Астон показав, що усі ізотопи мають атомні маси пропорційні до атомної маси водню, а елементи, атомна маса яких відхиляється від цього правила, є сумішами ізотопів. Наприклад, хлор у природі існує у вигляді двох ізотопів з масами 35 і 37, а його атомна маса, що вважалася рівною 35.45, насправді є середнім зваженим мас цих ізотопів (відповідно до їх часток у природному хлорі).[2]
І Фредерік Содді і Френсіс Астон за свої роботи з відкриття і дослідження ізотопів отримали нобелівські премії з хімії, у 1921 і 1922 році відповідно.[3]
У 1932 році був відкритий нейтрон, і згодом стало зрозуміло, що саме різна кількість нейтронів у ядрі відрізняє ізотопи один від одного. У 1934 році Фредерік та Ірен Жоліо-Кюрі виявили, що при бомбардуванні легких елементів альфа-частинками утворюються короткоживучі ізотопи деяких легких елементів, а розпад таких ізотопів іде по невідомому раніше каналу (β+), і супроводжується емісією позитронів[4]. В той же час Енріко Фермі показав, що опромінення стабільних елементів нейтронами призводить до їх захоплення ядрами, і утворення нових ізотопів цих же елементів. Усі ці явища отримали назву штучна радіоактивність. За допомогою таких методів фізики отримали можливість створювати велику кількість нестабільних ізотопів.
Більшість відомих ізотопів нестабільні щодо радіоактивного розпаду. Характеристиками нестабільних ізотопів є період напіврозпаду та канал розпаду. Основними каналами розпаду є бета-радіоактивність та альфа-радіоактивність. При бета-розпаді ядро ізотопу випромінює електрон або позитрон і, відповідно, або збільшує, або зменшує свій атомний номер. При альфа-розпаді ядро ізотопу випромінює альфа-частинку, і відповідно, його атомний номер зменшується на двійку, а масове число на 4. Деякі ізотопи, наприклад, 235U, можуть ділитися.
Період напіврозпаду нестабільних ізотопів може бути дуже різним, від 1× 10-24 c до значень, що перевищують вік Всесвіту. В останньому випадку слабку радіоактивність можна зареєструвати точними вимірюваннями, однак ізотоп можна вважати практично стабільним.
В навколишній природі зустрічаються здебільшого стабільні ізотопи хімічних елементів, оскільки нестабільні врешті-решт розпадаються. Однак вони також і утворюються внаслідок ядерних реакцій.
Загалом, існує 254 стабільних ізотопи, що належать 81 елементу, при тому, що загалом відомо 3339 різних ізотопів[5]. З цих ізотопів, теоретично, лише 90 є повністю стабільними, а решта просто має дуже довгі періоди напіврозпаду, проте на практиці їх розпад не спостерігався.
Розподіл елементів за кількістю стабільних ізотопів такий:[6]
- 10 стабільних ізотопів — 1 елемент (олово)
- 8 стабільних ізотопів — 1 елемент (ксенон)
- 7 стабільних ізотопів у чотирьох елементів
- 6 стабільних ізотопів мають вісім елементів
- 5 стабільних ізотопів мають десять елементів
- 4 стабільних ізотопи є у дев'яти елементів
- три стабільні ізотопи є у п'яти елементів
- 16 елементів мають два стабільні ізотопи, рахуючи метастабільний збуджений стан танталу-180m
- 26 елементів представлені лише одним нуклідом
У багатьох галузях використовуються речовини зі зміщеним ізотопним складом. В першу чергу це стосується урану, радіоактивний нуклід якого (з атомною масою 235), є вкрай вживаним у виробництві зброї, ядерній енергетиці, тощо. Загалом, проблема розділення ізотопів є вкрай складною, через те, що хімічно вони практично еквівалентні.
Існує дві великих групи методів розділення ізотопів: абсолютні методи, які дозволяють виділити ізотопи в чистому вигляді, а також методи, що лише збільшують концентрацію деякого нукліду.
До абсолютних методів відносять:
- Електромагнітне розділення: суміш ізотопів випаровують і іонізують, прискорюють електричним полем, після чого запускають в камеру з магнітним полем, перпендикулярним напрямку руху іонів. Таким чином, відхилення окремих атомів у полі є пропорційним відношенню m/z (яке є різним для різних ізотопів), і суміш розділяється на окремі пучки ізотопів, що вловлюються і відокремлюються.
- Лазерне розділення, що працює завдяки тому, що молекули, що містять різні ізотопи, збуджуються під дією світла різної частоти. Потім збуджені молекули відокремлюються електричним полем чи будь-яким іншим способом.
Проте, хоча абсолютне розділення здається більш ефективним, через велику вартість, в промислових масштабах воно використовується порівняно рідше. Натомість застосовується велика кількість методів, що ненабагато зміщує пропорції ізотопів у зразку. Для того, щоб отримати порівняно чистий ізотоп, ці методи треба застосовувати багато разів. Щоб оцінити ефективність розділення, використовується показник, що називається коефіцієнт сепарації, що розраховується як , де N1 і N2 — концентрації ізотопу, що виділяється, у збагаченій і у збідненій фракції. Серед методів такого типу можна відмітити такі[7]:
- Газова дифузія: швидкості молекул легких ізотопів більші, ніж важких, тому при пропусканні через мембрану газу, що складається з суміші ізотопів, легкі ізотопи проходять швидше.
- Термодифузія: при існуванні градієнту температури у рідині чи газі атоми легких ізотопів частіше опиняються у більш теплих місцях, тому у цих зонах їх концентрація підвищується.
- Дистиляція: при переведенні речовини у стан рівноваги між рідиною і парою легкий ізотоп концентрується в парі.
- Газові центрифуги: при розкрученні газової суміші ізотопів у центрифузі легкі ізотопи концентруються біля осі.
- Ізотопний обмін: при контакті двох різних сполук розділюваного елементу, що перебувають у різних фазах, різні ізотопи концентруються в різних фракціях,
- Електроміграція іонів: при прикладенні електричного поля до розплаву або розчину іони різних ізотопів рухаються з різною швидкістю.
В найкращих з цих методів коефіцієнти розділення не перевищують відсотка, тому для ефективного збагачення потрібно повторювати процес сотні або тисячі разів.[8]
Оскільки різні ізотопи мають різний період напіврозпаду, то, знаючи вихідну концентрацію ізотопів у речовині, замірявши її пізніше, можна дізнатися вік зразка.
Найбільш відомим прикладом такого використання є радіовуглецевий метод: вуглець-14 (т. зв. радіовуглець) постійно утворюється в атмосфері під час реакції ядер азоту з космічними променями і розпадається з періодом напіврозпаду 5370 років. Ці протилежні процеси компенсують один одного, тому концентрація цього ізотопу в атмосфері є постійною, близько 1 атому 14С на 1012 атомів стабільного вуглецю. Допоки деякий організм живе, він постійно обмінюється вуглецем з навколишнім середовищем, тому та сама концентрація встановлюється і в ньому. Коли організм помирає і процеси обміну речовин у ньому припиняються, доля вуглецю-14 у ньому починає зменшуватися. Таким чином, вимірявши питому активність 14С в вуглецю, виділеному з залишків того чи іншого організму, можна доволі точно визначити, коли саме жив цей організм. Зручність цього методу полягає в тому, що вуглець входить до складу практично всіх організмів, тому такий метод є доволі універсальним. З іншого боку, через відносно короткий період напіврозпаду, радіовуглецевий метод може використовуватися лише для датування віку організмів, що не старіші за 60 000 років.
Для мінералів застосовують калій-аргоновий та уран-свинцевий методи, що дозволяють датувати більші часові інтервали.
Через хімічну нероздільність, радіоактивні ізотопи можуть використовуватися організмом (або брати участь у хімічних реакціях) так само, як і звичайні. Це дозволяє дуже точно спостерігати за шляхами метаболізму того чи іншого елементу (або речовини, деякі атоми якої замінені) у організмі. Ця методика є широко вживаною в біології, медицині і техніці.
Природний кисень представлений трьома стабільними ізотопами кисень-16, кисень-17 і кисень-18. Незважаючи на хімічну подібність, ізотопи трохи по різному беруть участь у таких процесах як випаровування і конденсація, тому концентрація кисню-18 у океані залежить від клімату планети (а саме від розміру льодовиків). Цей факт використовують для того, щоб дізнатися кліматичні умови в далекому минулому — досліджуючи льодяні керни з полярних льодовиків, або визначаючи концентрацію цих ізотопів у мушлях скам'янілостей. [9]
На відміну від урану-238, в урані-235 можлива самопідтримувана ланцюгова реакція. Це найбільш розповсюджений у природі ізотоп, що має такі властивості, через що саме він використовується при виробництві ядерної зброї, а також в атомних реакторах. При цьому його концентрація в природному урані становить лише 0,72%, тому дуже важливим є питання розділення ізотопів.
У медицині, на використанні явища ядерного магнітного резонансу побудовані кілька важливих діагностичних технік, таких як ЯМР-спектроскопія і магнітно-резонансна томографія. Проте, ядерний магнітний резонанс виникає за рахунок магнітних властивостей ядра, а тому такі методики працюють лише для ядер, що мають нецілий спін. Таким чином, лише ізотопи з непарним числом нуклонів можуть використовуватися для цього.[10]
- ↑ Elements and Atoms: Chapter 20 [Архівовано 23 грудня 2016 у Wayback Machine.](англ.)
- ↑ Mass spectra and isotopes [Архівовано 9 серпня 2017 у Wayback Machine.](англ.)
- ↑ All Nobel Prizes in Chemistry [Архівовано 5 грудня 2015 у Wayback Machine.](англ.)
- ↑ Штучна радіоактивність. Архів оригіналу за 18 грудня 2016. Процитовано 24 грудня 2016.
- ↑ National Nuclear Data Center. Архів оригіналу за 23 грудня 2016. Процитовано 25 грудня 2016. [Архівовано 2016-12-23 у Wayback Machine.]
- ↑ Chart of Nuclides [Архівовано 10 жовтня 2018 у Wayback Machine.](англ.)
- ↑ ИЗОТОПОВ РАЗДЕЛЕНИЕ [Архівовано 24 грудня 2016 у Wayback Machine.](рос.)
- ↑ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ МЕТОДЫ [Архівовано 25 грудня 2016 у Wayback Machine.](рос.)
- ↑ Изотопы в климатологических исследованиях [Архівовано 6 червня 2015 у Wayback Machine.](рос.)
- ↑ FAQ: Ядерный магнитный резонанс [Архівовано 25 грудня 2016 у Wayback Machine.](рос.)
- Деркач Ф. А. Хімія : посібник для вступ. до вузів / Ф. А. Деркач. — Л. : Видавництво Львівського університету, 1968. — 312 с.
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Ізотопи [Архівовано 3 вересня 2017 у Wayback Machine.] //ЕСУ
- А. М. Бризицька. Ізотопи // Фармацевтична енциклопедія [Архівовано 3 жовтня 2016 у Wayback Machine.]
- М. Д. Корнієнко. Ізотопи // Українська радянська енциклопедія [Архівовано 18 жовтня 2016 у Wayback Machine.]
- М. Д. Корнієнко. Радіоактивні зотопи // Українська радянська енциклопедія [Архівовано 18 жовтня 2016 у Wayback Machine.]
- (англ.) Nuclides [Архівовано 16 липня 2015 у Wayback Machine.] — таблиця ізотопів.
- (рос.) Хімічна енциклопедія онлайн. [Архівовано 18 липня 2010 у Wayback Machine.]

