Вакцина проти грипу
Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Вакцини проти грипу — це вакцина, яка захищає від зараження вірусами грипу.[1] Нові версії вакцин розробляються двічі на рік, оскільки вірус грипу швидко змінюється.[1] Хоча їхня ефективність різниться від року до року, більшість із них забезпечують помірний та високий захист від грипу.[1][2] Центр з контролю та профілактики захворювань США оцінює, що вакцинація проти грипу зменшує кількість захворювань, відвідувань лікарів, госпіталізацій та смертності.[3][4] Імунізовані працівники, які захворіли на грип, повертаються на роботу в середньому на півдня швидше.[5] Ефективність вакцини для осіб старше 65 років залишається невизначеною через відсутність якісних досліджень.[6][7] Щеплення дітей може захистити оточуючих.[1]
Вона знаходиться у Орієнтовному переліку основних лікарських засобів, розробленому ВООЗ.[8]
Вакцини використовуються як для людей, так і для нелюдських істот. Мається на увазі вакцина для людини, якщо вона спеціально не зазначена ветеринарна, пташина або тваринницька вакцини.
У всесвітній пандемії іспанського грипу 1918 р. "Фармацевти пробували все, що їм було відомо, усе, про що вони коли-небудь чули, від древнього мистецтва кровопускання хворим до введення кисню, до розробки нових вакцин і сироватки (головним чином проти того, що ми тепер називають Hemophilus influenzae – іменем, похідним від того, що спочатку вважалося етіологічним агентом – та декількома видами пневмококів). Тільки один терапевтичний засіб — переливання крові від одужалих пацієнтів новим хворим, показав будь-який натяк на успіх ".[9]
Розробка вакцини проти грипу розпочалася в 30-х роках 20-го століття, а широкомасштабна доступність у США розпочалася з 1945 року.[10][11]
У 1931 р. Ернест Вільям Гудпасчер[en] та його колеги з Університету Вандербільта повідомили про ріст вірусів у зародках у курячих яйцях. Робота була розширена до вирощування вірусу грипу кількома працівниками, зокрема Томасом Френсісом[en] , Джонасом Солком, Вільсоном Смітом та Макфарлейном Бернетом, що призвело до першої експериментальної вакцини.[12] У 1940-х роках американські військові вперше затвердили вакцини з інактивованого вакцини вірусу грипу, які використовувались у Другій світовій війні.[13] Яйця курей продовжували використовувати для виробництва вірусу, який використовується у вакцинах проти грипу, але виробники вдосконалили чистоту вірусу, розробивши вдосконалені процеси видалення яєчних білків та зниження системної реактивності вакцини.[14] У 2012 році Управління з продовольства і медикаментів США (FDA) затвердило вакцини проти грипу, виготовлені шляхом вирощування вірусу в культурі клітин[15][16][17] та були затверджені вакцини проти грипу, виготовлені з рекомбінантних білків[18], при цьому вакцини проти грипу на рослинній основі[en] тестуються [коли?] у клінічних випробуваннях.[19]

Відповідно до CDC: "Вакцинація проти грипу є основним методом запобігання грипу та його важким ускладненням. […] Вакцинація пов'язана зі зменшенням захворювань дихальних шляхів, пов'язаних з грипом, та відвідування лікарів серед усіх вікових груп, госпіталізації та смерті серед осіб з груп високого ризику, зменшенням середнього отиту серед дітей та прогулів на роботі серед дорослих. Хоча рівень вакцинації проти грипу значно зріс протягом 1990-х років, необхідні подальші вдосконалення рівня охоплення вакциною ".[20]
Технологія на основі яєць (яка все ще використовується станом на 2019) для виробництва вакцини проти грипу була створена в 1950-х роках.[21] У США під час спалаху свинячого грипу 1976 року[en] президент Джеральд Форд зіткнувся з потенційною пандемією свинячого грипу. Програма вакцинації була прискореною, проте страждала від затримок та проблем зі зв'язками з громадськістю. Тим часом максимальні зусилля військових по стримуванню несподівано зуміли обмежити новий розповсюдження на єдиній армійській базі, де воно виникло. На цій базі кілька солдатів важко захворіли, але лише один загинув. Програму було скасовано після щеплення близько 24 % населення. За оцінками, перевищення смертності на двадцять п'ять років над нормальним річним рівнем, а також чотириста надмірних госпіталізацій, як від синдром Гійєна — Барре, сталося через саму програму вакцинації, ілюструючи, що сама вакцина не є вільною від ризиків. Результат цитується, щоб викликати тривалі сумніви щодо вакцинації.[22] Врешті-решт, навіть недоброякісна вакцина 1976 року, можливо, врятувала життя. Дослідження 2010 року виявило значно посилену імунну відповідь проти пандемії 2009 року H1N1 у учасників дослідження, які отримали вакцинацію проти свинячого грипу в 1976 році.[23]
Чотиривалентна вакцина проти грипу, що вводиться розпиленням у носі, була затверджена FDA у березні 2012 року.[24][25] Fluarix Quadrivalent була затверджена FDA у грудні 2012 року.[26]
У 2014 році Канадський національний консультативний комітет з імунізації[en] (NACI) опублікував огляд чотиривалентних вакцин проти грипу.[27]Починаючи з сезону грипу 2018—2019 років, більшість вакцин проти грипу на основі яєць, всі рекомбінантні та вирощені на клітинах вакцини проти грипу в США є чотиривалентними.[28] У сезоні грипу 2019—2020 рр. всі регулярні щеплення грипу звичайними дозами та всі рекомбінантні вакцини проти грипу в Сполучених Штатах є чотиривалентними.[29]
У листопаді 2019 року FDA схвалила високодозову чотиривалентну вакцину Fluzone для використання в США, починаючи з сезону грипу 2020—2021.[30][31]
У лютому 2020 року FDA схвалила Fluad Quadrivalent для використання в США.[32][33] У липні 2020 року FDA схвалила як Fluad, так і Fluad Quadrivalent для використання в США на сезон грипу 2020—2021 років.[32][34]
Центр з контролю та профілактики захворювань (CDC) США рекомендує вакцину проти грипу як найкращий спосіб захистити людей від грипу та запобігти його поширенню.[35] Вакцина проти грипу може також зменшити ступінь тяжкості грипу, якщо людина заразилася штамом, якого вакцина не містила.[35] Потрібно приблизно два тижні після вакцинації для утворення захисних антитіл.[35]
Всесвітня організація охорони здоров'я (ВООЗ) та США Центри з контролю та профілактики захворювань (CDC) рекомендують проводити щорічну вакцинацію майже всім людям у віці старше шести місяців, особливо особам з високим ризиком.[1][36][37][38] Європейський центр з профілактики та контролю захворюваності (ECDC) також рекомендує проводити щорічну вакцинацію груп високого ризику.[39] До цих груп належать вагітні жінки, люди похилого віку, діти у віці від шести місяців до п'яти років, особи з певними проблемами зі здоров'ям та ті, хто працює в галузі охорони здоров'я.[1][38]
У 2012 році мета-аналізом було встановлено, що вакцинація проти грипу була ефективною 67 відсотків випадків; популяції, які отримали найбільший зиск, були: ВІЛ-позитивні дорослі у віці від 18 до 55 років (76 відсотків), здорові дорослі віком від 18 до 46 років (приблизно 70 відсотків), та здорові діти у віці від шести місяців до 24 місяців (66 відсотків).[40] Вакцина проти грипу також захищає від інфаркту міокарда з користю від 15 до 45 %.[41]
| 2004 | 10 % |
|---|---|
| 2005 | 21 % |
| 2006 | 52 % |
| 2007 | 37 % |
| 2008 | 41 % |
| 2009 | 56 % |
| 2010 | 60 % |
| 2011 | 47 % |
| 2012 | 49 % |
| 2013 | 52 % |
| 2014 | 19 % |
| 2015 | 48 % |
| 2016 | 40 % |
| 2017 | 38 % |
| 2018 | 29 % |
| 2019 | 45 % est |
Вакцина оцінюється за її дієвістю — ступенем, до якого вона знижує ризик захворювання в контрольованих умовах, — та за її ефективністю — спостереженим зниженням ризику після введення вакцини.[45] У випадку грипу, ефективність, як очікується, буде нижчою, ніж дієвість, оскільки вона вимірюється із використанням показників грипоподібних хвороб[en] , які не завжди спричинені грипом.[5] Вакцини проти грипу зазвичай демонструють високу дієвість, що вимірюється виробленням антитіл на тваринних моделях або вакцинованих людях.[46] Однак дослідження ефективності вакцин проти грипу в реальному світі важкі; вакцини можуть бути недосконалими, поширеність вірусів сильно варіюється в роках, а грип часто плутають з іншими грипоподібними захворюваннями.[47] Однак у більшість років (16 з 19 років до 2007 року) вакцинні штами грипу добре підходили циркулюючим штамам,[48] і навіть невідповідна вакцина часто може забезпечити перехресний захист.[35] Вірус швидко змінюється внаслідок антигенного дрейфу, незначної мутації вірусу, що призводить до появи нового штаму.[49]
Повторна щорічна вакцинація проти грипу зазвичай забезпечує стабільний щорічний захист від грипу.[50] Однак є суперечливі докази того, що багаторазові щеплення можуть спричинити зниження ефективності вакцини для деяких підтипів грипу; це не стосується сучасних рекомендацій щодо щорічних щеплень, але може вплинути на майбутню політику вакцинації.[51][52] Станом на 2019 CDC рекомендує щорічну вакцинацію, оскільки більшість досліджень демонструють загальну ефективність щорічної вакцинації проти грипу.[50]
Том Джефферсон[en], який очолював огляди Кокранівською співпрацею вакцин проти грипу, назвав клінічні дані щодо вакцин проти грипу «сміттям» і, отже, визнав їх неефективними; він закликав провести плацебо-контрольовані рандомізовані клінічні випробування[en], яке більшість у цій галузі вважають неетичним. Його погляди на ефективність вакцин проти грипу відкидаються медичними закладами, зокрема CDC та Національний інститут охорони здоров'я США, а також ключовими діячами у цій галузі, такими як Ентоні Фаучі.[53]
Майкл Остерхольм[en], який очолив Центр досліджень та політики щодо інфекційних хвороб[en] 2012 року щодо вакцин проти грипу, рекомендував отримати вакцину, але критикував її просування, кажучи: "Ми надмірно пропагували та перехайпували цю вакцину … це не захищає так, як це рекламується. Це все робота з продажу: це все зв'язки з громадськістю ".[54]
CDC рекомендує, щоб усі, крім немовлят віком до шести місяців, отримували сезонну вакцину проти грипу.[36] Вакцинаційні кампанії[en] зазвичай приділяють особливу увагу людям, які мають високий ризик серйозних ускладнень, якщо вони захворіли на грип, такі як вагітні жінки, діти до 59 місяців, літні і люди з хронічними захворюваннями або ослаблена імунна система, а також ті, з ким вони взаємодіють, наприклад, медичні працівники.[36][55]
Оскільки рівень смертності також високий серед немовлят, які підхоплюють грип, CDC та ВООЗ рекомендують вакцинувати домочадців та доглядачів немовлят, щоб зменшити ризик передачі немовляті грипозної інфекції.[55][56]
У дітей вакцина знижує ризик грипу та, можливо, грипоподібної хвороби.[57] Для дітей віком до двох років дані обмежені.[57] Протягом сезону грипу 2017–18 років директор CDC зазначив, що 85 відсотків дітей, які померли, «ймовірно, не були щеплені».[58]
У США, станом на січень 2019 року, CDC рекомендує, щоб діти віком від шести до 35 місяців могли отримувати дозу або 0,25 мілілітра, або 0,5 мілілітра Fluzone Чотиривалентного.[29][59] Для цієї вікової групи немає переваги щодо того чи іншого обсягу дози Fluzone Чотиривалентного.[29] Усі особи віком від 36 місяців і старше повинні отримувати дозу 0,5 мілілітра Fluzone Чотиривалентного.[29] Станом на жовтень 2018, Afluria Quadrivalent має ліцензію для дітей віком від шести місяців у США.[29][60] Діти віком від 6 місяців до 35 місяців повинні отримувати дозу 0,25 мілілітра на кожну Afluria Quadrivalent.[29] Усі особи віком від 36 місяців повинні отримувати дозу 0,5 мілілітрів Afluria Quadrivalent.[29] Станом на лютий 2018, Afluria Tetra має ліцензію для дорослих та дітей віком від 5 років у Канаді.[61]
У 2014 р. Канадський Національний консультативний комітет з імунізації (NACI) опублікував огляд вакцинації проти грипу у здорових 5–18-річних дітей,[62] а в 2015 році опублікував огляд використання дитячого препарату Флюад у дітей віком 6–72 місяців.[63] В одному дослідженні, проведеному у вищому центрі направлення, рівень вакцинації проти грипу у дітей становив лише 31 %. Вищі показники були виявлені серед дітей-пацієнтів з пригнічених імунітетом (46 %) та у пацієнтів із запальними захворюваннями кишківника (50 %).[64]

Серед невакцинованих дорослих 16 % мають симптоми, подібні до грипу, тоді як серед вакцинованих дорослих їх мають близько 10 %.[5] Вакцинація зменшила підтверджені випадки грипу приблизно з 2,4 % до 1,1 %.[5] Впливу на госпіталізацію виявлено не було.[5]
У дорослих, які працюють, огляд, проведений Кокранівською співпрацею, показав, що вакцинація призвела до помірного зменшення як симптомів грипу, так і втрачених робочих днів, не впливаючи на передачу та ускладнення, пов'язані з грипом.[5] У здорових дорослих дорослих вакцини проти грипу можуть забезпечити помірний захист від вірусологічно підтвердженого грипу, хоча такий захист значно знижується або відсутній у деякі сезони.[6]
Для медичних працівників огляд 2006 року виявив чисту вигоду.[65] З вісімнадцяти досліджень, проведених у цьому огляді, лише два також оцінювали взаємозв'язок смертності пацієнтів щодо рівня вживання вакцин проти грипу; обидва виявили, що більш високі показники вакцинації медичних працівників корелювали зі зменшенням смертності пацієнтів.[65] Огляд 2014 року виявив переваги для пацієнтів при імунізації медичних працівників, що підтверджується помірними доказами[66] частково заснованими на спостережуваному зниженні смертності від усіх причин у пацієнтів, чиїм медичним працівникам проводилася імунізація, порівняно з контрольними пацієнтами, у яких працівникам не пропонували вакцини.[67]
Докази щодо ефекту у дорослих старше 65 років незрозумілі.[68] Систематичні огляди, що вивчають як рандомізовані контрольовані, так і дослідження "випадок-контроль", виявили відсутність високоякісних доказів.[6][7] Огляди контрольних досліджень виявили наслідки щодо лабораторно підтвердженого грипу, пневмонії та смерті серед людей похилого віку.[69][70]
Найбільш вразлива група, яка не має пандемічного грипу, — люди похилого віку — мають найменшу користь від вакцини. У цього різкого зниження ефективності вакцин існує безліч причин, найпоширенішими з яких є зниження імунологічної функції та слабкість, пов'язані з похилим віком.[71] У непандемічний рік людина у Сполучених Штатах у віці 50–64 років має майже в десять разів більше шансів померти від смерті, пов'язаної з грипом, ніж молодша особа, а людина старше 65 років у десять разів частіше помирає смерть, пов'язана з грипом, ніж вікова група 50–64 років.[72]
Існує високодозова вакцина проти грипу, спеціально розроблена для забезпечення більш сильної імунної відповіді.[73] Наявні дані свідчать, що вакцинація літніх людей вакциною у високих дозах призводить до сильнішої імунної відповіді проти грипу, ніж вакциною зі звичайними дозами.[74][75][76]
Вакцина проти грипу, що містить ад'ювант, була схвалена Управлінням з продовольства і медикаментів США у листопаді 2015 року для використання дорослими у віці 65 років і старше. Вакцина продається під назвою Fluad в США і вперше була доступна в сезоні грипу 2016—2017 років. Вакцина містить ад'ювант MF59C.1[en][77] який є емульсією сквалену у воді. Це перша ад'ювантна вакцина проти сезонного грипу, що продається в США.[78][79][80] Неясно, чи є суттєва користь для літніх людей від використання вакцини проти грипу, що містить ад'ювант MF59C.1.[81][82][83] Відповідно до керівних принципів Дорадчого комітету з питань імунізації[en], Fluad можна використовувати як альтернативу іншим вакцинам проти грипу, дозволеним для людей віком від 65 років.[79]
У багатьох країнах рекомендується робити щеплення медичним працівникам, які працюють із літніми людьми, з метою зменшення спалахів грипу у цього вразливого населення.[84][85][86] Хоча немає жодних переконливих доказів від рандомізованого клінічного випробування, що вакцинація медичних працівників допомагає захистити людей похилого віку від грипу, є попередні докази користі.[87]
Fluad Quad була схвалена для використання в Австралії у вересні 2019 року,[88] Fluad Quadrivalent було схвалено для використання в США в лютому 2020 року,[32] і Fluad Tetra було схвалено для використання в Європейському Союзі в травні 2020 року.[89]
Окрім захисту матері та дитини від наслідків грипозної інфекції, імунізація вагітних жінок, як правило, збільшує їхні шанси пережити успішну доношену вагітність.[90]
Тривалентна інактивована вакцина проти грипу захищає вагітних жінок, інфікованих ВІЛ.[91]
Хоча можуть виникати побічні ефекти від вакцини проти грипу, вони, як правило, незначні, включаючи хворобливість, почервоніння та набряки навколо місця ін'єкції, головний біль, лихоманку, нудоту або втому.[92] Побічні ефекти вакцини у вигляді назального спрею можуть включати нежить, хрипи, біль у горлі, кашель або блювоту.[93]
У деяких людей вакцина проти грипу може викликати серйозні побічні ефекти, включаючи алергічна реакція, але це буває рідко. Крім того, загальні побічні ефекти та ризики є помірними та тимчасовими порівняно з ризиками та серйозними наслідками щорічної епідемії грипу.[35]
Хоча синдрому Гійєна — Барре боялись як ускладнення вакцинації, CDC зазначає, що більшість досліджень сучасних вакцин проти грипу не бачать жодного зв'язку з синдромом Гійєна — Барре.[94][95] Сама інфекція вірусом грипу збільшує як ризик смерті (до одного з десяти тисяч), так і ризик розвитку синдрома Гійєна — Барре на набагато вищий рівень, ніж найвищий рівень підозри на участь вакцини (приблизно в десять разів вище) за оцінками 2009 р.).[96][97]
Незважаючи на те, що в одному огляді наводиться оцінка у приблизно один випадок синдрому Гійєна-Барре на мільйон щеплень,[98] велике дослідження в Китаї, яке охоплювало близько ста мільйонів доз вакцини проти «свинячого» грипу H1N1 2009 року, виявило лише одинадцять випадків синдрому Гійєна — Барре, (0,1 на мільйон доз) загальної захворюваності у людей, щеплених, фактично нижче, ніж нормальний рівень захворювання в Китаї, і ніяких інших помітних побічних ефектів.[97][99]

Хоча більшість вакцин проти грипу виробляються з використанням методів на основі яєць, проте протигрипозні вакцини все ще рекомендуються людям з алергією на яйця[en], навіть у важких випадках.[100] Дослідження, що вивчають безпеку вакцин проти грипу у людей з важкою алергією на яйця, виявили, що анафілаксія була дуже рідкісною, і траплялася в 1,3 випадки на мільйон введених доз.[100] Моніторинг симптомів вакцинації рекомендується проводити пацієнтам з більш серйозними симптомами.[101]У дослідженні майже 800 дітей з алергією на яйця, у тому числі понад 250 із попередніми анафілактичними реакціями, було зареєстровано нульові системні алергічні реакції при введенні вакцини проти грипу з живого послабленого віруса[en].[102][103]
У кількох дослідженнях було виявлено підвищену частоту нарколепсії серед реципієнтів пандемічної вакцини проти грипу H1N1 з ад'ювантом ASO3;[104] зусилля, спрямовані на виявлення механізму цього, дозволяють припустити, що нарколепсія є аутоімунною, і що вакцина H1N1 з ад'ювантом ASO3 може імітувати гіпокретин, що слугує пусковим механізмом.[105]
Деякі вакцини проти грипу на основі ін'єкцій, призначені для дорослих у США, містять тіомерсал[en] (також відомий як тимеросал), консервант на основі ртуті.[106][107] Незважаючи на деякі суперечки[en] у ЗМІ,[108] Глобальний консультативний комітет з питань безпеки вакцин Всесвітньої організації охорони здоров'я дійшов висновку, що немає доказів токсичності тіомерсалу у вакцинах і немає причин з міркувань безпеки переходити на більш дороге одноразове введення дози.[109]
Вакцини проти грипу доступні як:
- тривалентна або чотиривалентна внутрішньом'язова ін'єкція (IIV3, IIV4 або RIV4, тобто TIV або QIV), яка містить інактивовану форму вірусу;
- назальний спрей з вакциною з живого послабленого віруса грипу[en] (LAIV, Q / LAIV), що містить живу, але ослаблену (ослаблену) форму вірусу.
TIV або QIV індукують захист після ін'єкції (зазвичай внутрішньом'язово, хоча підшкірні та внутрішньошкірні шляхи введення також можуть використовуватись)[110] на основі імунної відповіді на антигени, присутні в інактивованому вірусі, тоді як оброблена холодом LAIV працює шляхом встановлення інфекції в носових ходах.[111]
20 вересня Управління з контролю за якістю харчових продуктів і медикаментів США схвалило першу вакцину проти грипу для самостійного застосування – назальний спрей від AstraZeneca для людей від 2 до 49 років. Спрей істить ослаблені штами вірусу грипу, доступний за рецептом і не потребує медичного персоналу для введення.[112]
Різні громадські організації охорони здоров'я, включаючи Всесвітню організацію охорони здоров'я (ВООЗ), рекомендують регулярно проводити щорічну вакцинацію проти грипу, особливо людям, яким загрожує ускладнення грипу, та особам, які живуть з особами з високим ризиком або доглядають за ними в тому числі:
- люди похилого віку (Велика Британія рекомендує осіб віком від 65 років)
- люди з хронічними захворюваннями легенів (астма, хронічне обструктивне захворювання легень тощо)
- люди з хронічними захворюваннями серця (вроджені вади серця, хронічна серцева недостатність, ішемічна хвороба серця)
- люди з хронічними захворюваннями печінки (включаючи цироз)
- люди з хронічними захворюваннями нирок (наприклад, нефротичний синдром)
- люди, яким видалили селезінку або селезінка не працює належним чином
- люди, які страждають на імунітет (люди з ВІЛ, ті, хто отримує ліки для подавлення імунної системи, та люди, які перебувають на хімієтерапії) та їхні домашні контакти
- люди, які живуть разом у великій кількості в середовищі, де грип може швидко поширюватися, наприклад, в'язницях, будинках престарілих, школах та гуртожитках.[113]
- медичні працівники (як для запобігання хворобам, так і для запобігання поширенню на своїх пацієнтів)[114][115]
- вагітні жінки.
Однак огляд 2009 року дійшов висновку, що недостатньо доказів, що рекомендували б регулярне використання тривалентної вакцини проти грипу протягом першого триместру вагітності.[116] Вакцинація проти грипу протягом сезону грипу[en] є частиною рекомендацій щодо щеплення проти грипу вагітних жінок у Сполучених Штатах[en].[117]
Вакцина проти грипу протипоказана особам віком до шести місяців та особам, які страждають серйозною алергією, що загрожує життю, на вакцину проти грипу або будь-який інгредієнт вакцини.[36][118][100]
Станом на 2016 р. Всесвітня організація охорони здоров'я (ВООЗ) рекомендує вакцинацію проти сезонного грипу для:[119][120][121][122][123]У першу чергу:
- вагітні
У другу чергу (без певного порядку):
- Діти віком 6–59 місяців
- Люди похилого віку
- Особи з особливими хронічними захворюваннями
- Медичні працівники
Національний консультативний комітет з імунізації (NACI), група, яка консультує Агентство охорони здоров'я Канади[en], рекомендує заохочувати всіх, хто старше шести місяців, робити щорічну вакцинацію проти грипу, а також дітям у віці до шести місяців і 24 місяці, а також їхнім побутовим контактам.[124] Зокрема:
- Люди з високим ризиком ускладнень, пов'язаних з грипом, або госпіталізації, включаючи тих, що страждають ожирінням, здорових вагітних жінок, дітей 6–59 місяців, людей похилого віку, аборигенів та людей, які страждають на одне із хронічних захворювань у детальних переліках
- Люди, здатні переносити грип людям з високим ризиком, включаючи домашні контакти та медичних працівників
- Люди, які надають основні суспільні послуги
- Деякі птахофабрики
Вакцина проти грипу з живого послабленого вірусу не була доступна в Канаді протягом сезону 2019—2020 років.[124]
Європейський центр з профілактики та контролю захворюваності (ECDC) рекомендує вакцинацію людей похилого віку в якості пріоритету, причому другим пріоритетом є люди із хронічними захворюваннями та медичні працівники.[125]
Стратегія вакцинації проти грипу, як правило, полягає у захисті вразливих людей, а не в обмеженні циркуляції грипу або усуненні людської грипозної хвороби в повному обсязі. Це відрізняється від стратегій високого колективного імунітету щодо інших інфекційних захворювань, таких як поліомієліт та кір.[126] Це також частково пов'язано з фінансовим та логістичним навантаженням, пов'язаним з необхідністю щорічних ін'єкцій.[127]

У Сполучених Штатах планова вакцинація проти грипу рекомендується всім особам у віці від шести місяців і старше.[128][129][130] Після вакцинації потрібно до двох тижнів, щоб в організмі з'явилася достатня кількість антитіл.[130] CDC рекомендує вакцинацію до кінця жовтня, хоча вважає отримання вакцини в січні або навіть пізніше все ще корисним.[35][130]
Відповідно до CDC, вакцина з живого послабленого віруса грипу (LAIV4) (яка поставляється у формі назального спрею в США) слід уникати наступним категоріям:[38][131]
- діти молодше двох років;
- дорослі від п'ятдесяти років і старше;
- при супутній терапії, що містить аспірин або саліцилат, у дітей та підлітків;
- діти у віці від двох до чотирьох років, які отримали діагноз астма або чиї батьки або доглядачі повідомляють, що протягом останніх дванадцяти місяців медичний працівник повідомляв їм про те, що їхня дитина хрипила або мала астму, або чия медична карта вказує на те, що стався хрип протягом останніх дванадцяти місяців;
- особи, які мають послаблений на імунітет з будь-якої причини (включаючи, але не обмежуючись, ліками та ВІЛ-інфекцією);
- особи з тісними контактами та особи, які доглядають за людьми з важким послабленим імунітетом, які потребують захищеного середовища;
- вагітні жінки;
- особи, які отримували противірусні препарати проти грипу протягом попередніх 48 годин.
У рамках своєї загальної рекомендації щодо загальної вакцинації в США CDC, яка почала рекомендувати вакцину проти грипу медичним працівникам у 1981 році, наголошує на клініцистах, що особливу актуальність вакцинації мають члени певних вразливих груп та їх доглядальники[en]:
- Вакцинація особливо важлива для людей з підвищеним ризиком серйозних ускладнень грипу або людей, які живуть з людьми з підвищеним ризиком серйозних ускладнень або доглядають за ними.[132] У 2009 році було затверджено нову високу дозу стандартної вакцини проти грипу.[133] Висока доза Fluzone призначена спеціально для людей старше 65 років; різниця полягає в тому, що вона містить чотирикратну дозу антигену від стандартного Fluzone.[134][135][136][137]
Уряд США вимагає, щоб лікарні повідомляли про рівень вакцинації робітників. Деякі штати США та сотні лікарень США вимагають від медичних працівників або робити щеплення, або носити маски під час сезону грипу. Ці вимоги час від часу породжують позови профспілок у колективних спорах, але прихильники зазначають, що суди, як правило, схвалюють закони про примусові вакцинації, що зачіпають загальне населення під час спалахів хвороб.[138]
Вакцинація проти грипу особливо вважається важливою для членів груп високого ризику, які, ймовірно, матимуть ускладнення від грипу, наприклад, вагітних жінок[128][139] а також дітей та підлітків від шести місяців до 18 років, які отримують препарати, що містять аспірин або саліцилат, і які можуть мати ризик виникнення синдрому Рейє після зараження вірусом грипу;[38][113]
- Підвищуючи верхню вікову межу до 18 років, метою є зменшення часу, який діти та батьки втрачають від відвідування педіатрів та відсутності у школі, а також потреби в антибіотиках для ускладнень[140]
- Додатковою перевагою, яка очікується від вакцинації дітей, є зменшення кількості випадків грипу серед батьків та інших членів домогосподарства та можливе поширення на загальну спільноту.[140]
CDC вказав, що вакцину з живого послабленого віруса грипу (LAIV), яку також називають назальною вакциною у формі спрею, не рекомендується використовувати в сезоні грипу 2016—2017 років у США.[141]
Крім того, CDC рекомендує медичному персоналу, який доглядає за особами з важким імунітетом, робити ін'єкції (TIV або QIV), а не LAIV.[142]
Уряд Австралії рекомендує сезонні щеплення від грипу всім, хто старше шести місяців. Австралія використовує інактивовані вакцини[en].[143] До 2021 року вакцина на основі яєць була єдиною доступною (і продовжує залишатися єдиною безкоштовною), але з березня 2021 року доступна нова вакцина на клітинній основі для тих, хто бажає за неї заплатити, і очікується що цей стане стандартним до 2026 року.[144]
Стандартна вакцина проти грипу безкоштовна для таких людей:[145]
- діти у віці від шести місяців до п'яти років;
- люди віком від 65 років;
- жителі островів аборигенів та протоки Торреса віком від шести місяців і старше;
- вагітні жінки; і
- будь-хто старше шести місяців із такими захворюваннями, як важка астма, захворювання легенів або серця, низький імунітет або діабет, що може призвести до ускладнень грипу.

Продовжуються дослідження ідеї універсальної вакцини проти грипу[en] , яка не потребує пристосування до певного штаму, але буде ефективною проти широкого кола вірусів грипу.[146] Однак до листопада 2007 року жодних кандидатів на вакцину не було оголошено.[147]
У звіті за 2007 рік загальна потреба приблизно 826 мільйонів доз сезонної вакцини проти грипу (інактивованої та живої) була вдвічі більшою, ніж виробництво 413 мільйонів доз. За агресивного сценарію виробництва вакцин пандемічного грипу[en] до 2013 року за півроку можна було виготовити лише 2,8 мільярда курсів. Якби всі країни з високим та середнім рівнем доходу шукали вакцини для всього свого населення в умовах пандемії, було б потрібно майже два мільярди курсів. Якби Китай також переслідував цю мету, для обслуговування цього населення було б потрібно понад три мільярди курсів.[148] Продовжуються дослідження та розробки вакцин з метою виявлення нових підходів до вакцин, які можуть виробляти набагато більшу кількість вакцин за ціною, доступною для світового населення.
Більшість вакцин проти грипу виробники вакцин вирощують у запліднених курячих яйцях.[149][147] У північній півкулі виробничий процес починається після оголошення (як правило, у лютому) штамів, рекомендованих ВООЗ для зимового сезону грипу.[149][150] Відбирають три штами (що представляють штам H1N1, H3N2 та B) грипу, а курячі яйця інокулюють окремо. Потім ці одновалентні вирощені віруси об'єднують для отримання тривалентної вакцини.[151]
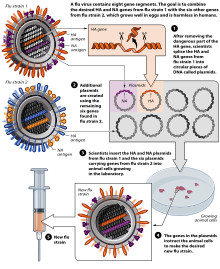
Станом на 2007 р., як звичайна ін'єкційна форма, так і назальний спрей виготовляються з використанням курячих яєць. Європейський Союз також затвердив Optaflu, вакцину, вироблену компанією Novartis з використанням клітин тварин. Очікується, що ця методика буде більш масштабованою та дозволяє уникнути проблем з яйцями, таких як алергічні реакції та несумісність із штамами, які вражають птахів, таких як кури.[147]
Вакцини проти грипу виробляються у вільних від патогенів яйцях віком одинадцять або дванадцять днів.[152] Верхня частина яйця дезінфікується протиранням спиртом, а потім у яйці просвічуванням визначають нежилкову ділянку в аллантоїсній порожнині, де проколюють невеликий отвір для скидання тиску.[153] Другий отвір робиться у верхній частині яйцеклітини, де вірус грипу вводиться в аллантоїсну порожнину повз хоріоланлантоїсну мембрану. Потім два отвори герметизують розплавленим парафіном, а інокульовані яйця інкубують протягом 48 годин при 37 градусах Цельсія.[152] Під час інкубації вірус реплікується, а репліковані віруси виділяються в алантоєву рідину.[154]
Після 48-годинного інкубаційного періоду верхівка яйцеклітини тріскається і видаляється десять мілілітрів алантоїсної рідини, з якої можна отримати близько п'ятнадцяти мікрограмів вакцини проти грипу. На даний момент віруси ослаблені або знищені, а вірусний антиген очищається і поміщається всередину флаконів, шприців або носових розпилювачів.[154] Цей широкомасштабний метод використовується для виробництва вакцини проти грипу для людської популяції.
Методи виробництва вакцин, які обходять потребу в яйцях, включають побудову вірусоподібних частинок[en] (VLP) грипу. VLP нагадують віруси, але немає потреби в їх інактивації, оскільки вони не включають вірусні кодуючі елементи, а просто представляють антигени, подібні до віріону. Деякі методи отримання VLP включають культури клітин Sf9[en] комах Spodoptera frugiperda[en] і виробництво вакцин на рослинній основі (наприклад, виробництво в Nicotiana benthamiana). Є дані, що деякі VLP викликають антитіла, які розпізнають ширшу групу антигенно відмінних вірусних ізолятів порівняно з іншими вакцинами при аналізі інгібування гемаглютинації (HIA).[155]
ДНК-вакцина на основі генів, яка використовувалась для підготовки імунної системи після посилення інактивованою вакциною H5N1, пройшла клінічні випробування в 2011 році.[156][157][158]
20 листопада 2012 р. Novartis отримав схвалення FDA для першої вакцини на основі клітинних культур.[159][16][160][161] У 2013 році рекомбінантну вакцину проти грипу, Flublok, було схвалено для використання в США.[18][162][163][164]
17 вересня 2020 р. Комітет з лікарських засобів для використання людьми[en] (CHMP) Європейського агентства з лікарських засобів (EMA) прийняв позитивний висновок, рекомендуючи надати дозвіл на продаж Supemtek, чотиривалентної вакцини (рекомбінантної, приготовленої в культурі клітин).[165] Заявником цього лікарського засобу є Санофі Пастер.[165] Supemtek був схвалений для медичного використання в Європейському Союзі в листопаді 2020 року.[166]
Австралія дозволила свою першу вакцину на основі клітин у березні 2021 року на основі «вічної клітинної лінії» нирки собаки. Завдяки способу його виробництва, вона виробляє краще підібрану вакцину (до штамів грипу).[144]
- ↑ а б в г д е ((World Health Organization)) (November 2012). Vaccines against influenza WHO position paper. Weekly Epidemiological Record. 87 (47): 461—76. hdl:10665/241993. PMID 23210147.
{{cite journal}}: Проігноровано невідомий параметр|lay-url=(довідка) - ↑ Manzoli L, Ioannidis JP, Flacco ME, De Vito C, Villari P (July 2012). Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses. Human Vaccines & Immunotherapeutics. 8 (7): 851—62. doi:10.4161/hv.19917. PMC 3495721. PMID 22777099.
- ↑ Rolfes MA, Foppa IM, Garg S, Flannery B, Brammer L, Singleton JA, Burns E, Jernigan D, Reed C, Olsen SJ, Bresee J (9 грудня 2016). 2015–2016 Estimated Influenza Illnesses, Medical visits, and Hospitalizations Averted by Vaccination in the United States. U.S. Centers for Disease Control and Prevention (CDC). Архів оригіналу за 2 грудня 2019. Процитовано 24 грудня 2017.
{{cite web}}: Недійсний|display-authors=6(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ ((Centers for Disease Control and Prevention)) (16 January 2020). Benefits of Flu Vaccination During 2018-2019 Flu Season. Centers for Disease Control and Prevention (CDC). Архів оригіналу за 6 березня 2020. Процитовано 10 April 2020.
- ↑ а б в г д е Demicheli V, Jefferson T, Ferroni E, Rivetti A, Di Pietrantonj C (February 2018). Vaccines for preventing influenza in healthy adults. Cochrane Database of Systematic Reviews. 2: CD001269. doi:10.1002/14651858.CD001269.pub6. PMC 6491184. PMID 29388196.
- ↑ а б в Osterholm MT, Kelley NS, Sommer A, Belongia EA (January 2012). Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. The Lancet. Infectious Diseases. 12 (1): 36—44. doi:10.1016/S1473-3099(11)70295-X. PMID 22032844.
- ↑ а б Demicheli V, Jefferson T, Di Pietrantonj C, Ferroni E, Thorning S, Thomas RE, Rivetti A (February 2018). Vaccines for preventing influenza in the elderly. Cochrane Database of Systematic Reviews. 2: CD004876. doi:10.1002/14651858.CD004876.pub4. PMC 6491101. PMID 29388197.
- ↑ ((World Health Organization)) (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ Institute of Medicine (2005). Knobler SL, Mack A, Mahmoud A, Lemon SM (ред.). The Threat of Pandemic Influenza: Are We Ready? Workshop Summary. The National Academies Press. с. 62. doi:10.17226/11150. ISBN 978-0-309-09504-4. PMID 20669448.
- ↑ Compans RW (2009). Vaccines for pandemic influenza. Dordrecht: Springer. с. 49. ISBN 978-3540921653. Архів оригіналу за 3 серпня 2020. Процитовано 2 травня 2021.
{{cite book}}: Проігноровано невідомий параметр|df=(довідка) - ↑ Vaccine Analysis: Strategies, Principles, and Control. Springer. 2014. с. 61. ISBN 978-3662450246. Архів оригіналу за 3 серпня 2020. Процитовано 2 травня 2021.
{{cite book}}: Проігноровано невідомий параметр|df=(довідка) - ↑ Plotkin, S.L. and Plotkin, S.A. «A short history of vaccination». In: Vaccines, Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit, eds. Elsevier Health Sciences, 2008, pp. 6–7.
- ↑ Artenstein, A.W. «Influenza» In: Vaccines: A Biography Andrew W. Artenstein, ed. pp. 191—205.
- ↑ Hampson AW (June 2008). Vaccines for pandemic influenza. The history of our current vaccines, their limitations and the requirements to deal with a pandemic threat. Annals of the Academy of Medicine, Singapore. 37 (6): 510—17. PMID 18618064.
- ↑ Milián E, Kamen AA (2015). Current and emerging cell culture manufacturing technologies for influenza vaccines. Biomed Res Int. 2015: 504831. doi:10.1155/2015/504831. PMC 4359798. PMID 25815321.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б FDA approves first seasonal influenza vaccine manufactured using cell culture technology (Пресреліз). U.S. Food and Drug Administration (FDA). Архів оригіналу за 2 січня 2013.
{{cite press release}}: Проігноровано невідомий параметр|df=(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Cell-Based Flu Vaccines. U.S. Centers for Disease Control and Prevention (CDC). 11 жовтня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б FDA approves new seasonal influenza vaccine made using novel technology (Пресреліз). U.S. Food and Drug Administration (FDA). 16 січня 2013. Архів оригіналу за 18 травня 2013.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Landry N, Ward BJ, Trépanier S, Montomoli E, Dargis M, Lapini G, Vézina LP (December 2010). Preclinical and clinical development of plant-made virus-like particle vaccine against avian H5N1 influenza. PLOS ONE. 5 (12): e15559. Bibcode:2010PLoSO...515559L. doi:10.1371/journal.pone.0015559. PMC 3008737. PMID 21203523.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Bridges CB, Fukuda K, Uyeki TM, Cox NJ, Singleton JA (April 2002). Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP) (PDF). Recommendations and Reports (MMWR). 51 (RR-3): 1—31. PMID 12002171. Архів (PDF) оригіналу за 21 серпня 2017.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Osterholm MT (May 2005). Preparing for the next pandemic. The New England Journal of Medicine. 352 (18): 1839—42. CiteSeerX 10.1.1.608.6200. doi:10.1056/NEJMp058068. PMID 15872196.
- ↑ Swine Flu Epidemics. 9 жовтня 1999. Архів оригіналу за 9 жовтня 1999.
- ↑ McCullers JA, Van De Velde LA, Allison KJ, Branum KC, Webby RJ, Flynn PM (June 2010). Recipients of vaccine against the 1976 "swine flu" have enhanced neutralization responses to the 2009 novel H1N1 influenza virus. Clinical Infectious Diseases. 50 (11): 1487—92. doi:10.1086/652441. PMC 2946351. PMID 20415539.
- ↑ First Quadrivalent Vaccine Against Seasonal Flu Wins FDA Approval. Архів оригіналу за 4 березня 2012.
- ↑ FDA approves first quadrivalent vaccine to prevent seasonal influenza (Пресреліз). U.S. Food and Drug Administration (FDA). Архів оригіналу за 21 грудня 2012.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ December 14, 2012 Approval Letter – Fluarix Quadrivalent. U.S. Food and Drug Administration (FDA). Архів оригіналу за 2 січня 2013.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ National Advisory Committee on Immunization (NACI) (July 2014). Literature review on quadrivalent influenza vaccines (PDF). Ottawa. ISBN 978-1-100-24682-6. Cat.: HP40-117/2014E-PDF Pub.: 140118. Архів оригіналу (PDF) за 1 серпня 2020. Процитовано 11 січня 2020.
{{cite book}}: Проігноровано|website=(довідка) - ↑ What You Should Know for the 2018-2019 Influenza Season. Centers for Disease Control and Prevention (CDC). 10 січня 2019. Архів оригіналу за 6 серпня 2020. Процитовано 5 лютого 2020.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б в г д е ж ((Centers for Disease Control and Prevention (CDC))), ((National Center for Immunization and Respiratory Diseases (NCIRD))) (5 листопада 2019). Frequently Asked Influenza (Flu) Questions: 2019–2020 Season. U.S. Centers for Disease Control and Prevention (CDC). Архів оригіналу за 1 грудня 2019. Процитовано 30 листопада 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Fluzone High-Dose Quadrivalent. U.S. Food and Drug Administration (FDA). 4 листопада 2019. STN: BL 103914. Архів оригіналу за 12 січня 2020. Процитовано 5 лютого 2020.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ FDA approves Fluzone High-Dose Quadrivalent (Influenza Vaccine) for adults 65 years of age and older. Sanofi (Пресреліз). 4 листопада 2019. Архів оригіналу за 1 серпня 2020. Процитовано 5 лютого 2020.
- ↑ а б в Fluad Quadrivalent. U.S. Food and Drug Administration (FDA). 2 July 2020. STN: 125510. Архів оригіналу за 11 серпня 2020. Процитовано 25 August 2020.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Seqirus Receives FDA Approval for Fluad Quadrivalent for Adults 65 Years and Older. Seqirus (Пресреліз). 24 лютого 2020. Архів оригіналу за 26 серпня 2020. Процитовано 25 серпня 2020.
- ↑ Seqirus Begins Shipping 2020/21 Influenza Vaccines to U.S. Market. Seqirus (Пресреліз). 30 липня 2020. Архів оригіналу за 26 серпня 2020. Процитовано 25 серпня 2020.
- ↑ а б в г д е Key Facts About Seasonal Flu Vaccine. U.S. Centers for Disease Control and Prevention (CDC). 2 грудня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б в г Who Should and Who Should NOT get a Flu Vaccine. U.S. Centers for Disease Control and Prevention (CDC). 11 жовтня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ World Health Organization (October 2017). The immunological basis for immunization series: module 23: influenza vaccines. World Health Organization (WHO). hdl:10665/259211. ISBN 978-9241513050.
- ↑ а б в г Grohskopf LA, Alyanak E, Broder KR, Walter EB, Fry AM, Jernigan DB (August 2019). Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices – United States, 2019–20 Influenza Season (PDF). MMWR. Recommendations and Reports. 68 (3): 1—21. doi:10.15585/mmwr.rr6803a1. PMC 6713402. PMID 31441906. Архів оригіналу (PDF) за 25 грудня 2020. Процитовано 15 червня 2021.
{{cite journal}}: Проігноровано невідомий параметр|lay-url=(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Implementation of the Council Recommendation on seasonal influenza vaccination (2009/1019/EU) (PDF). European Centre for Disease Prevention and Control. January 2014. Архів оригіналу (PDF) за 10 квітня 2020. Процитовано 10 квітня 2020.
{{cite journal}}: Проігноровано невідомий параметр|lay-url=(довідка) - ↑ Osterholm MT, Kelley NS, Sommer A, Belongia EA (January 2012). Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. The Lancet. Infectious Diseases. 12 (1): 36—44. doi:10.1016/s1473-3099(11)70295-x. PMID 22032844.
- ↑ MacIntyre, CR; Mahimbo, A; Moa, AM; Barnes, M (15 грудня 2016). Influenza vaccine as a coronary intervention for prevention of myocardial infarction. Heart (British Cardiac Society). 102 (24): 1953—56. doi:10.1136/heartjnl-2016-309983. PMC 5256393. PMID 27686519.
- ↑ Past Seasons Vaccine Effectiveness Estimates. U.S. Centers for Disease Control and Prevention (CDC). 29 січня 2020. Архів оригіналу за 12 лютого 2020. Процитовано 4 березня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Doyle JD, Chung JR, Kim SS, Gaglani M, Raiyani C, Zimmerman RK, Nowalk MP, Jackson ML, Jackson LA, Monto AS, Martin ET, Belongia EA, McLean HQ, Foust A, Sessions W, Berman L, Garten RJ, Barnes JR, Wentworth DE, Fry AM, Patel MM, Flannery B (February 2019). Interim Estimates of 2018-19 Seasonal Influenza Vaccine Effectiveness – United States, February 2019 (PDF). MMWR. Morbidity and Mortality Weekly Report. 68 (6): 135—39. doi:10.15585/mmwr.mm6806a2. PMC 6375657. PMID 30763298. Архів оригіналу (PDF) за 2 липня 2020. Процитовано 3 травня 2021.
{{cite journal}}: Недійсний|display-authors=6(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Dawood FS, Chung JR, Kim SS, Zimmerman RK, Nowalk MP, Jackson ML, Jackson LA, Monto AS, Martin ET, Belongia EA, McLean HQ, Gaglani M, Dunnigan K, Foust A, Sessions W, DaSilva J, Le S, Stark T, Kondor RJ, Barnes JR, Wentworth DE, Brammer L, Fry AM, Patel MM, Flannery B (February 2020). Interim Estimates of 2019-20 Seasonal Influenza Vaccine Effectiveness – United States, February 2020 (PDF). Morbidity and Mortality Weekly Report (MMWR). 69 (7): 177—82. doi:10.15585/mmwr.mm6907a1. PMC 7043386. PMID 32078591. Архів оригіналу (PDF) за 2 серпня 2020. Процитовано 3 травня 2021.
{{cite journal}}: Недійсний|display-authors=6(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Fedson DS (1998). Measuring protection: efficacy versus effectiveness. Developments in Biological Standardization. 95: 195—201. PMID 9855432.
- ↑ Stephenson I, Zambon MC, Rudin A, Colegate A, Podda A, Bugarini R, Del Giudice G, Minutello A, Bonnington S, Holmgren J, Mills KH, Nicholson KG (May 2006). Phase I evaluation of intranasal trivalent inactivated influenza vaccine with nontoxigenic Escherichia coli enterotoxin and novel biovector as mucosal adjuvants, using adult volunteers. Journal of Virology. 80 (10): 4962—70. doi:10.1128/JVI.80.10.4962-4970.2006. PMC 1472052. PMID 16641287.
{{cite journal}}: Недійсний|display-authors=6(довідка) - ↑ Jefferson T (October 2006). Influenza vaccination: policy versus evidence. BMJ. 333 (7574): 912—15. doi:10.1136/bmj.38995.531701.80. PMC 1626345. PMID 17068038.
- ↑ 2007–2008 Influenza (Flu) Season. U.S. Centers for Disease Control and Prevention (CDC). 26 червня 2008. Архів оригіналу за 6 березня 2008.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Carrat, F.; Flahault, A. (28 вересня 2007). Influenza vaccine: The challenge of antigenic drift. Vaccine. 25 (39): 6852—62. doi:10.1016/j.vaccine.2007.07.027. ISSN 0264-410X. PMID 17719149.
- ↑ а б Vaccine Effectiveness: How Well Do the Flu Vaccines Work?. U.S. Centers for Disease Control and Prevention (CDC). 12 жовтня 2018. Архів оригіналу за 25 жовтня 2019. Процитовано 24 жовтня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Ramsay LC, Buchan SA, Stirling RG, Cowling BJ, Feng S, Kwong JC, Warshawsky BF (January 2019). The impact of repeated vaccination on influenza vaccine effectiveness: a systematic review and meta-analysis. BMC Med. 17 (1): 9. doi:10.1186/s12916-018-1239-8. PMC 6327561. PMID 30626399.
{{cite journal}}: Недійсний|display-authors=6(довідка)Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Belongia EA, Skowronski DM, McLean HQ, Chambers C, Sundaram ME, De Serres G (July 2017). Repeated annual influenza vaccination and vaccine effectiveness: review of evidence. Expert Rev Vaccines. 16 (7): 723—36. doi:10.1080/14760584.2017.1334554. PMID 28562111.
- ↑ Brownlee S (1 листопада 2009). Does the Vaccine Matter?. The Atlantic. Архів оригіналу за 9 грудня 2014. Процитовано 8 грудня 2014.
- ↑ Rabin RC (5 листопада 2012). Reassessing Flu Shots as the Season Draws Near. The New York Times. Архів оригіналу за 10 листопада 2016. Процитовано 30 грудня 2016.
'We have overpromoted and overhyped this vaccine,' said Michael T. Osterholm, director of the Center for Infectious Disease Research and Policy, as well as its Center of Excellence for Influenza Research and Surveillance. 'It does not protect as promoted. It's all a sales job: it's all public relations.'
- ↑ а б Influenza (Seasonal). World Health Organization (WHO). 6 листопада 2018. Архів оригіналу за 25 жовтня 2019. Процитовано 24 жовтня 2019.
- ↑ Study of Flu-Related Deaths in Children Shows Healthy Children at Risk. U.S. Centers for Disease Control and Prevention (CDC). 12 лютого 2018. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V (February 2018). Vaccines for preventing influenza in healthy children. Cochrane Database of Systematic Reviews. 2: CD004879. doi:10.1002/14651858.CD004879.pub5. PMC 6491174. PMID 29388195.
- ↑ Steenhuysen J (22 січня 2018). U.S. CDC director urges flu vaccinations as pediatric deaths mount. Reuters. Архів оригіналу за 6 травня 2021. Процитовано 26 січня 2018.
- ↑ Fluzone High-Dose Quadrivalent. U.S. Food and Drug Administration (FDA). 14 листопада 2019. Архів оригіналу за 1 грудня 2019. Процитовано 30 листопада 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Afluria Quadrivalent. U.S. Food and Drug Administration (FDA). 8 листопада 2019. Архів оригіналу за 1 грудня 2019. Процитовано 30 листопада 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ ((National Advisory Committee on Immunization (NACI))) (November 2018). Supplemental Statement – Afluria Tetra – An Advisory Committee Statement (ACS). Public Health Agency of Canada. Ottawa. Cat.: HP37-25E-PDF Pub.: 180566. Архів оригіналу за 12 січня 2020. Процитовано 11 січня 2020.
- ↑ Literature review on influenza vaccination in healthy 5–18-year-olds (PDF) (Звіт). Ottawa: Public Health Agency of Canada. July 2014. ISBN 978-1-100-24681-9. Cat.: HP40-116/2014E-PDF Pub.: 140116. Архів оригіналу (PDF) за 1 серпня 2020. Процитовано 3 травня 2021.
- ↑ Literature Review on Pediatric Fluad Influenza Vaccine Use in Children 6–72 Months of Age (PDF) (Звіт). Ottawa: Public Health Agency of Canada. 2015. Архів оригіналу (PDF) за 17 травня 2020. Процитовано 11 січня 2020.
- ↑ Peleg, Noam; Zevit, Noam; Shamir, Raanan; Chodick, Gabriel; Levy, Itzhak (January 2015). Seasonal influenza vaccination rates and reasons for non-vaccination in children with gastrointestinal disorders. Vaccine. 33 (1): 182—86. doi:10.1016/j.vaccine.2014.10.086. PMID 25444802.
- ↑ а б Burls A, Jordan R, Barton P, Olowokure B, Wake B, Albon E, Hawker J (May 2006). Vaccinating healthcare workers against influenza to protect the vulnerable – is it a good use of healthcare resources? A systematic review of the evidence and an economic evaluation. Vaccine. 24 (19): 4212—21. doi:10.1016/j.vaccine.2005.12.043. PMID 16546308.
- ↑ Ahmed F, Lindley MC, Allred N, Weinbaum CM, Grohskopf L (January 2014). Effect of influenza vaccination of healthcare personnel on morbidity and mortality among patients: systematic review and grading of evidence. Clinical Infectious Diseases. 58 (1): 50—57. doi:10.1093/cid/cit580. PMID 24046301.
- ↑ Griffin MR (January 2014). Influenza vaccination of healthcare workers: making the grade for action. Clinical Infectious Diseases. 58 (1): 58—60. doi:10.1093/cid/cit590. PMID 24046312.
- ↑ Simonsen L, Viboud C, Taylor RJ, Miller MA, Jackson L (October 2009). Influenza vaccination and mortality benefits: new insights, new opportunities. Vaccine. 27 (45): 6300—04. doi:10.1016/j.vaccine.2009.07.008. PMID 19840664.
- ↑ Darvishian M, Bijlsma MJ, Hak E, van den Heuvel ER (December 2014). Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: a meta-analysis of test-negative design case-control studies. The Lancet. Infectious Diseases. 14 (12): 1228—39. doi:10.1016/S1473-3099(14)70960-0. PMID 25455990.
- ↑ Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E (October 2007). Effectiveness of influenza vaccine in the community-dwelling elderly. The New England Journal of Medicine. 357 (14): 1373—81. doi:10.1056/NEJMoa070844. PMID 17914038. S2CID 14850833. Архів оригіналу за 16 лютого 2021. Процитовано 5 травня 2021.
- ↑ Simonsen L, Taylor RJ, Viboud C, Miller MA, Jackson LA (October 2007). Mortality benefits of influenza vaccination in elderly people: an ongoing controversy. The Lancet. Infectious Diseases. 7 (10): 658—66. doi:10.1016/S1473-3099(07)70236-0. PMID 17897608.
- ↑ Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ, Fukuda K (January 2003). Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA. 289 (2): 179—86. doi:10.1001/jama.289.2.179. PMID 12517228. S2CID 5018362.
- ↑ High Dose Flu Vaccine for the Elderly « Science-Based Medicine. Sciencebasedmedicine.org. Архів оригіналу за 8 травня 2013. Процитовано 17 жовтня 2013.
- ↑ Fluzone High-Dose Seasonal Influenza Vaccine. U.S. Centers for Disease Control and Prevention (CDC). 6 вересня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
- ↑ DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A та ін. (August 2014). Efficacy of high-dose versus standard-dose influenza vaccine in older adults. The New England Journal of Medicine. 371 (7): 635—45. doi:10.1056/NEJMoa1315727. PMID 25119609. S2CID 205096393. Архів оригіналу за 28 серпня 2021. Процитовано 5 травня 2021.
- ↑ Wells C, Grobelna A (8 січня 2019). High Dose Influenza Vaccine for Adults: A Review of Clinical Effectiveness, Cost-Effectiveness, and Guidelines (PDF). Rapid Response Report. Ottawa: Canadian Agency for Drugs and Technologies in Health (CADTH). ISSN 1922-8147. PMID 31141324. Архів оригіналу (PDF) за 1 серпня 2020. Процитовано 5 травня 2021.
- ↑ Mascagni P, Vicenzi E, Kajaste-Rudnitski A, Pellicciotta G, Monti A, Cervi C та ін. (2012). Assessment of efficacy and safety of pandemic A/H1N1/2009 influenza vaccine in a group of health care workers. La Medicina del Lavoro. 103 (3): 220—29. PMID 22838300.
- ↑ FDA approves first seasonal influenza vaccine containing an adjuvant (Пресреліз). U.S. Food and Drug Administration. 24 листопада 2015. Архів оригіналу за 22 липня 2017. Процитовано 20 серпня 2017.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б Flu Vaccine With Adjuvant. U.S. Centers for Disease Control and Prevention (CDC). 4 вересня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Fluad. U.S. Food and Drug Administration (FDA). 8 листопада 2019. STN 125510. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Influenza vaccine with squalene adjuvant: new preparation. No better than available products. Prescrire International. 13 (74): 206—08. December 2004. PMID 15599987.
- ↑ Camilloni B, Basileo M, Valente S, Nunzi E, Iorio AM (2015). Immunogenicity of intramuscular MF59-adjuvanted and intradermal administered influenza enhanced vaccines in subjects aged over 60: A literature review. Human Vaccines & Immunotherapeutics. 11 (3): 553—63. doi:10.1080/21645515.2015.1011562. PMC 4514405. PMID 25714138.
{{cite journal}}: Проігноровано невідомий параметр|lay-url=(довідка) - ↑ Van Damme P, Arnou R, Kafeja F, Fiquet A, Richard P, Thomas S та ін. (May 2010). Evaluation of non-inferiority of intradermal versus adjuvanted seasonal influenza vaccine using two serological techniques: a randomised comparative study. BMC Infectious Diseases. 10: 134. doi:10.1186/1471-2334-10-134. PMC 2895601. PMID 20504306.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Haverkate M, D'Ancona F, Giambi C, Johansen K, Lopalco PL, Cozza V, Appelgren E, VENICE project gatekeepers contact points (May 2012). Mandatory and recommended vaccination in the EU, Iceland and Norway: results of the VENICE 2010 survey on the ways of implementing national vaccination programmes. Euro Surveillance. 17 (22). doi:10.2807/ese.17.22.20183-en. PMID 22687916.
- ↑ Field RI (November 2009). Mandatory vaccination of health care workers: whose rights should come first?. P & T. 34 (11): 615—18. PMC 2810172. PMID 20140133.
- ↑ Kassianos G (2015). Willingness of European healthcare workers to undergo vaccination against seasonal influenza: current situation and suggestions for improvement. Drugs in Context. 4: 212268. doi:10.7573/dic.212268. PMC 4316812. PMID 25657810.
- ↑ Thomas RE, Jefferson T, Lasserson TJ (June 2016). Influenza vaccination for healthcare workers who care for people aged 60 or older living in long-term care institutions. The Cochrane Database of Systematic Reviews (6): CD005187. doi:10.1002/14651858.CD005187.pub5. PMID 27251461.
- ↑ Fluad Quad Australian prescription medicine decision summary. Therapeutic Goods Administration (TGA). 13 December 2019. Архів оригіналу за 8 березня 2020. Процитовано 24 August 2020.
- ↑ Fluad Tetra EPAR. European Medicines Agency (EMA). 24 March 2020. Архів оригіналу за 1 серпня 2020. Процитовано 29 May 2020.
- ↑ Fell DB, Sprague AE, Liu N, Yasseen AS, Wen SW, Smith G, Walker MC (June 2012). H1N1 influenza vaccination during pregnancy and fetal and neonatal outcomes. American Journal of Public Health (Submitted manuscript). 102 (6): e33—40. doi:10.2105/AJPH.2011.300606. PMC 3483960. PMID 22515877.
- ↑ Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S та ін. (September 2014). Influenza vaccination of pregnant women and protection of their infants. The New England Journal of Medicine. 371 (10): 918—31. doi:10.1056/NEJMoa1401480. hdl:2263/42412. PMID 25184864.
- ↑ Flu shot. CDC. 2020. Архів оригіналу за 2 грудня 2019. Процитовано 24 вересня 2020.
- ↑ Misconceptions about flu vaccines. CDC. 2020. Архів оригіналу за 10 серпня 2020. Процитовано 24 вересня 2020.
- ↑ Haber P, Sejvar J, Mikaeloff Y, DeStefano F (2009). Vaccines and Guillain-Barré syndrome. Drug Safety. 32 (4): 309—23. doi:10.2165/00002018-200932040-00005. PMID 19388722. S2CID 33670594.
- ↑ Reorganized text. JAMA Otolaryngology–Head & Neck Surgery. 141 (5): 428. May 2015. doi:10.1001/jama.248.6.698. PMID 25996397.
- ↑ Stowe J, Andrews N, Wise L, Miller E (February 2009). Investigation of the temporal association of Guillain-Barre syndrome with influenza vaccine and influenza-like illness using the United Kingdom General Practice Research Database. American Journal of Epidemiology. 169 (3): 382—88. doi:10.1093/aje/kwn310. PMID 19033158.
- ↑ а б Sivadon-Tardy V, Orlikowski D, Porcher R, Sharshar T, Durand MC, Enouf V та ін. (January 2009). Guillain-Barré syndrome and influenza virus infection. Clinical Infectious Diseases. 48 (1): 48—56. doi:10.1086/594124. PMID 19025491.
- ↑ Vellozzi C, Burwen DR, Dobardzic A, Ball R, Walton K, Haber P (March 2009). Safety of trivalent inactivated influenza vaccines in adults: background for pandemic influenza vaccine safety monitoring. Vaccine. 27 (15): 2114—20. doi:10.1016/j.vaccine.2009.01.125. PMID 19356614. Архів оригіналу за 1 серпня 2020. Процитовано 6 травня 2021.
- ↑ Reinberg S (2 лютого 2011). Last Year's H1N1 Flu Vaccine Was Safe, Study Finds. U.S. News & World Report. Архів оригіналу за 25 квітня 2013.
- ↑ а б в Flu Vaccine and People with Egg Allergies. U.S. Centers for Disease Control and Prevention (CDC). 25 листопада 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ National Advisory Committee on Immunization (NACI) (August 2012). Statement on Seasonal Influenza Vaccine for 2012–2013 (PDF). Canadian Communicable Disease Report. Ottawa. 38. Архів оригіналу (PDF) за 17 січня 2013. Процитовано 18 липня 2013.
- ↑ Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M (December 2015). Safety of live attenuated influenza vaccine in young people with egg allergy: multicentre prospective cohort study. BMJ. 351: h6291. doi:10.1136/bmj.h6291. PMC 4673102. PMID 26645895.
- ↑ Greenhawt M (December 2015). Live attenuated influenza vaccine for children with egg allergy. BMJ. 351: h6656. doi:10.1136/bmj.h6656. PMID 26657778. S2CID 37037904.
- ↑ Technical Report: Narcolepsy in association with pandemic influenza vaccination (PDF). Stockholm, Sweden: European Centre for Disease Prevention and Control (ECDC). 2012. ISBN 978-92-9193-388-4. Архів оригіналу (PDF) за 31 грудня 2013. Процитовано 30 грудня 2013.
{{cite book}}: Проігноровано невідомий параметр|df=(довідка) - ↑ Yong E (2013). Narcolepsy confirmed as autoimmune disease. Nature. doi:10.1038/nature.2013.14413. S2CID 74850662.
- ↑ Thimerosal in Flu Vaccine. U.S. Centers for Disease Control and Prevention. 16 жовтня 2015. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Thimerosal in Vaccines Thimerosal – Concerns – Vaccine Safety. U.S. Centers for Disease Control and Prevention. 27 жовтня 2015. Архів оригіналу за 2 листопада 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Offit PA (September 2007). Thimerosal and vaccines – a cautionary tale. The New England Journal of Medicine. 357 (13): 1278—79. doi:10.1056/NEJMp078187. PMID 17898096. S2CID 36318722. Архів оригіналу за 28 серпня 2021. Процитовано 6 травня 2021.
- ↑ Global Advisory Committee on Vaccine Safety (14 липня 2006). Thiomersal and vaccines. World Health Organization (WHO). Архів оригіналу за 6 листопада 2009. Процитовано 20 листопада 2007.
- ↑ Plotkin & Mortimer (1988). Vaccines. Philadelphia: W.B. Saunders Company. с. 424. ISBN 978-0-7216-1946-0. Процитовано 7 вересня 2020.
- ↑ Product Monograph: Flumist (PDF), Astrazeneca Canada Inc., 20 червня 2014, архів оригіналу (PDF) за 30 вересня 2020, процитовано 5 вересня 2020
- ↑ Вакцина проти грипу.
- ↑ а б Fiore AE, Shay DK, Broder K, Iskander JK, Uyeki TM, Mootrey G та ін. (July 2009). Prevention and control of seasonal influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2009 (PDF). Recommendations and Reports (MMWR). 58 (RR-8): 1—52. PMID 19644442. Архів (PDF) оригіналу за 20 червня 2017.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ To KW, Lai A, Lee KC, Koh D, Lee SS (October 2016). Increasing the coverage of influenza vaccination in healthcare workers: review of challenges and solutions. The Journal of Hospital Infection. 94 (2): 133—42. doi:10.1016/j.jhin.2016.07.003. PMID 27546456.
- ↑ Rubin GJ, Potts HW, Michie S (March 2011). Likely uptake of swine and seasonal flu vaccines among healthcare workers. A cross-sectional analysis of UK telephone survey data. Vaccine. 29 (13): 2421—28. doi:10.1016/j.vaccine.2011.01.035. PMID 21277402.
- ↑ Skowronski DM, De Serres G (July 2009). Is routine influenza immunization warranted in early pregnancy?. Vaccine. 27 (35): 4754—70. doi:10.1016/j.vaccine.2009.03.079. PMID 19515466.
- ↑ Institute for Clinical Systems Improvement (July 2010). Health Care Guideline: Routine Prenatal Care (вид. Fourteenth). Архів оригіналу за 5 липня 2008.
- ↑ Seasonal Flu Shot. U.S. Centers for Disease Control and Prevention (CDC). 9 грудня 2019. Архів оригіналу за 2 грудня 2019. Процитовано 12 січня 2020.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Vaccine use. World Health Organization (WHO). Архів оригіналу за 15 грудня 2012. Процитовано 15 січня 2017.
- ↑ Influenza (Seasonal) Fact sheet. World Health Organization (WHO). November 2016. Архів оригіналу за 30 листопада 2014. Процитовано 15 січня 2017.
- ↑ Influenza (Seasonal). WHO. 6 листопада 2018. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
- ↑ Methods for assessing influenza vaccination coverage in target groups (2016). WHO/Europe. 19 березня 2018. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
- ↑ Recommendations on influenza vaccination during the 2019–2020 winter season. WHO/Europe. 24 вересня 2019. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
- ↑ а б Canadian Immunization Guide Chapter on Influenza and Statement on Seasonal Influenza Vaccine for 2019–2020 (PDF) (Звіт). Public Health Agency of Canada. May 2019. Cat.: HP37-25E-PDF; Pub.: 180883. Архів оригіналу (PDF) за 16 липня 2020. Процитовано 19 травня 2021.
{{cite report}}: Проігноровано невідомий параметр|lay-url=(довідка) - ↑ Risk groups for severe influenza. European Centre for Disease Prevention and Control (ECDC). Архів оригіналу за 22 жовтня 2019. Процитовано 22 жовтня 2019.
- ↑ ECDC Reviews – New WHO recommendations on seasonal influenza ... European Centre for Disease Prevention and Control (ECDC). Архів оригіналу за 10 травня 2017. Процитовано 25 грудня 2016.
- ↑ ECDC Guidance: Priority risk groups for influenza vaccination (PDF). European Centre for Disease Prevention and Control (ECDC). с. 7—8. Архів оригіналу (PDF) за 25 грудня 2016. Процитовано 25 грудня 2016.
- ↑ а б Fiore AE, Uyeki TM, Broder K, Finelli L, Euler GL, Singleton JA та ін. (August 2010). Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010 (PDF). Recommendations and Reports (MMWR). 59 (RR-8): 1—62. PMID 20689501. Архів (PDF) оригіналу за 21 вересня 2012.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Centers for Disease Control Prevention (CDC) (August 2012). Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP) – United States, 2012–13 influenza season (PDF). Morbidity and Mortality Weekly Report (MMWR). 61 (32): 613—18. PMID 22895385. Архів (PDF) оригіналу за 23 січня 2013.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б в Children & Influenza (Flu). U.S. Centers for Disease Control and Prevention (CDC). 23 жовтня 2019. Архів оригіналу за 11 листопада 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Live Attenuated Influenza Vaccine [LAIV] (The Nasal Spray Flu Vaccine). U.S. Centers for Disease Control and Prevention (CDC). 16 вересня 2019. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Influenza Vaccination: A Summary for Clinicians – Health Professionals – Seasonal Influenza (Flu). U.S. Centers for Disease Control and Prevention (CDC). 6 вересня 2018. Архів оригіналу за 24 лютого 2008.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Fluzone, Fluzone High-Dose and Fluzone Intradermal. U.S. Food and Drug Administration (FDA). 11 July 2017. Архів оригіналу за 22 July 2017. Процитовано 1 June 2020.
{{cite web}}: Обслуговування CS1:Сторінки з посиланнями на джерела, що мають непридатні URL (посилання) - ↑ Couch RB, Winokur P, Brady R, Belshe R, Chen WH, Cate TR та ін. (November 2007). Safety and immunogenicity of a high dosage trivalent influenza vaccine among elderly subjects. Vaccine. 25 (44): 7656—63. doi:10.1016/j.vaccine.2007.08.042. PMC 2243220. PMID 17913310.
- ↑ Lee JK, Lam GK, Shin T, Kim J, Krishnan A, Greenberg DP та ін. (May 2018). Efficacy and effectiveness of high-dose versus standard-dose influenza vaccination for older adults: a systematic review and meta-analysis. Expert Rev Vaccines. 17 (5): 435—443. doi:10.1080/14760584.2018.1471989. PMID 29715054. S2CID 21688517.
- ↑ Robertson CA, DiazGranados CA, Decker MD, Chit A, Mercer M, Greenberg DP (December 2016). Fluzone High-Dose Influenza Vaccine. Expert Rev Vaccines. 15 (12): 1495—1505. doi:10.1080/14760584.2016.1254044. PMID 27813430.
- ↑ Literature review update on the efficacy and effectiveness of high-dose (Fluzone High-Dose) and MF59-adjuvanted (Fluad) trivalent inactivated influenza vaccines in adults 65 years of age and older (PDF) (Звіт). Ottawa: Public Health Agency of Canada. May 2018. HP40-210/2018E-PDF. Архів оригіналу (PDF) за 21 липня 2020. Процитовано 1 червня 2020.
- ↑ Tanner L (13 січня 2013). Hospitals crack down on workers who refuse flu shots. NBC News. Архів оригіналу за 3 грудня 2013. Процитовано 24 липня 2014.
- ↑ Centers for Disease Control Prevention (CDC) (December 2010). Seasonal influenza and 2009 H1N1 influenza vaccination coverage among pregnant women – 10 states, 2009–10 influenza season (PDF). Morbidity and Mortality Weekly Report (MMWR). 59 (47): 1541—45. PMID 21124293. Архів (PDF) оригіналу за 25 червня 2017.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б Altman LK (28 лютого 2008). Panel Advises Flu Shots for Children Up to Age 18. The New York Times. Архів оригіналу за 22 січня 2015.
- ↑ ACIP votes down use of LAIV for 2016–2017 flu season (Пресреліз). U.S. Centers for Disease Control and Prevention (CDC). 22 червня 2016. Архів оригіналу за 25 листопада 2016. Процитовано 26 листопада 2016.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Immunization Schedules. U.S. Centers for Disease Control and Prevention (CDC). Архів оригіналу за 5 листопада 2014. Процитовано 4 листопада 2014.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Flu vaccine FAQs. Healthdirect, Department of Health, Government of Australia. 1 квітня 2019. Архів оригіналу за 29 травня 2019. Процитовано 29 травня 2019.
- ↑ а б Roberts L (27 березня 2021). Australia's first cell-based influenza vaccines to roll out this flu season. ABC News. Архів оригіналу за 27 квітня 2021. Процитовано 28 квітня 2021.
- ↑ Influenza fact sheet. Healthdirect, Department of Health, Government of Australia. 1 квітня 2019. Архів оригіналу за 29 травня 2019. Процитовано 29 травня 2019.
- ↑ Abbasi J (November 2019). The Search for a Universal Flu Vaccine Heats Up. JAMA. 322 (20): 1942—1944. doi:10.1001/jama.2019.16816. PMID 31693060. S2CID 207903441.
- ↑ а б в Greenfieldboyce N (8 листопада 2007). New and Old Ways to Make Flu Vaccines (Radio broadcast). NPR. Архів оригіналу за 24 жовтня 2019. Процитовано 23 жовтня 2019. Архівована копія. Архів оригіналу за 24 жовтня 2019. Процитовано 15 червня 2021.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ Influenza Vaccine Strategies for Broad Global Access. Path. October 2007. Архів оригіналу за 14 жовтня 2019. Процитовано 16 вересня 2009.
- ↑ а б how it's made (PDF). Архів оригіналу (PDF) за 5 липня 2010.
- ↑ Influenza vaccine viruses and reagents. World Health Organization (WHO). Архів оригіналу за 27 травня 2013.
- ↑ Recommendations for the production and control of influenza vaccine (inactivated) (PDF). World Health Organization (WHO). Архів (PDF) оригіналу за 28 жовтня 2013. Процитовано 27 травня 2013.
- ↑ а б Racaniello V (Dec 2009). Influenza virus growth in eggs. Virology Blog. Архів оригіналу за 25 грудня 2014.
- ↑ Izzat F (Apr 2012). Viral Cultivation in Chicken Embryo. Youtube. Архів оригіналу за 26 травня 2015.
{{cite web}}: Проігноровано невідомий параметр|df=(довідка) - ↑ а б How Influenza (Flu) Vaccines Are Made. U.S. Centers for Disease Control and Prevention (CDC). 26 листопада 2019. Архів оригіналу за 2 грудня 2019. Процитовано 2 грудня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Bright RA, Carter DM, Daniluk S, Toapanta FR, Ahmad A, Gavrilov V та ін. (May 2007). Influenza virus-like particles elicit broader immune responses than whole virion inactivated influenza virus or recombinant hemagglutinin. Vaccine. 25 (19): 3871—78. doi:10.1016/j.vaccine.2007.01.106. PMID 17337102.
- ↑ Priming with DNA vaccine makes avian flu vaccine work better (NIH News). 3 жовтня 2011. Архів оригіналу за 27 вересня 2012.
{{cite web}}: Проігноровано невідомий параметр|df=(довідка) - ↑ Номер клінічного дослідження NCT00776711 для "Vaccine for Prevention of Bird Flu" на вебсайті ClinicalTrials.gov
- ↑ Номер клінічного дослідження NCT01086657 для "An Open-Label, Randomized Phase I Study in Healthy Adults of the Safety and Immunogenicity of Prime-Boost Intervals with Monovalent Influenza Subunit Virion (H5N1) Vaccine, A/Indonesia/05/2005 (Sanofi Pasteur, Inc), Administered Alone or Following Recombinant DNA Plasmid (H5) Vaccine, VRC-AVIDNA036-00-VP (VRC, NIAID)" на вебсайті ClinicalTrials.gov
- ↑ Novartis receives FDA approval for Flucelvax, the first cell-culture vaccine in US to help protect against seasonal influenza (Пресреліз). Novartis. 20 листопада 2012. Архів оригіналу за 28 листопада 2012.
{{cite press release}}: Проігноровано невідомий параметр|df=(довідка) - ↑ Research, Center for Biologics Evaluation and. Approved Products – November 20, 2012 Approval Letter – Flucelvax. U.S. Food and Drug Administration (FDA). Архів оригіналу за 3 грудня 2012.
{{cite web}}: Проігноровано невідомий параметр|df=(довідка) Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Seqirus receives FDA approval for Flucelvax Quadrivalent (Influenza Vaccine) for people four years of age and older (Пресреліз). Seqirus. 23 травня 2016. Архів оригіналу за 16 січня 2017. Процитовано 15 січня 2017.
{{cite press release}}: Проігноровано невідомий параметр|df=(довідка) Архівована копія. Архів оригіналу за 16 січня 2017. Процитовано 15 червня 2021.{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ Roos R (14 жовтня 2019). FDA approves first flu vaccine grown in insect cells. Center for Infectious Disease Research and Policy (CIDRAP). Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
- ↑ Flublok. U.S. Food and Drug Administration (FDA). 26 лютого 2018. STN 125285. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ Flublok Quadrivalent. U.S. Food and Drug Administration (FDA). 2 серпня 2019. STN 125285. Архів оригіналу за 14 жовтня 2019. Процитовано 14 жовтня 2019.
 Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
Ця стаття містить текст з джерела, що зараз в суспільному надбанні.
- ↑ а б Supemtek: Pending EC decision. European Medicines Agency (EMA). 17 September 2020. Архів оригіналу за 23 вересня 2020. Процитовано 21 September 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ Supemtek EPAR. European Medicines Agency (EMA). 15 September 2020. Архів оригіналу за 10 січня 2021. Процитовано 27 November 2020.