Аргентометрія
Арге́нтометрі́я (від лат. argentum — срібло) — титриметричний метод для кількісного визначення аніонів, які утворюють із катіоном Ag+ малорозчинні сполуки. Найчастіше застосовується для визначення вмісту галогенідів (особливо хлоридів), тіоціанатів, ціанідів.
Методи аргентометрії ґрунтуються на утворенні малорозчинних сполук при взаємодії досліджуваної речовини та нітрату аргентуму:
В залежності від типу індикації кінцевої точки титрування, розрізняють метод Мора та метод Фаянса—Ходакова. Ці способи дозволяють проводити пряме визначення кількості невідомої речовини. Також застосовується зворотнє визначення (метод Фольгарда), яке є окремим випадком тіоціанатометрії: нітрат аргентуму, доданий у досліджуваний розчин у відомому надлишку, відтитровують розчином тіоціанатів.

За методом Мора титрування проводиться нітратом срібла із концентрацією 0,05 або 0,1 моль/л. Як індикатор використовується розчин хромату калію.
При титруванні галогенідів в першу чергу осаджуються галогеніди срібла (білий AgCl та жовтий AgBr):
- ; Ksp = 1,78·10-10
- ; Ksp = 5,35⋅10-13
Визначення йодидів за методом Мора не проводиться через їхню значну адсорбцію на поверхні осаду AgI та, як наслідок, спотворення результатів.
Після повного відтитровування галогенідів, катіони Ag+ вступають у взаємодію із хромат-аніонами, утворюючи осад цегляно-червоного кольору:
- ; Ksp = 2,1·10-12
Поява червоного забарвлення свідчить про досягнення кінцевої точки титрування.
Титрування проводиться у нейтральному або слабколужному середовищах (при pH 6,3—10,5). У кислому середовищі осад хромату срібла розчиняється, а в сильнолужному (pH ≥ 10) катіони Ag+ утворюють нерозчинний осад оксиду срібла(I):
У розчині повинні бути відсутніми іони, що утворюють осади з хромат-іонами та катіонами Ag+: катіони Ba2+, Pb2+, Hg22+, Bi3+, аніони PO43-, CO32-, C2O42-, AsO43-.
За методом Мора не проводять визначення вмісту галогенідних кислот та слабких основ, оскільки вони, внаслідок гідролізу, мають кисле середовище.
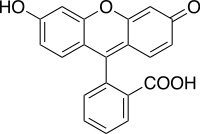
Метод заснований на утворенні осадів при взаємодії зі стандартним розчином нітрату срібла(I) у присутності адсорбційних індикаторів. Цим методом здебільшого визначають галогеніди (хлориди, броміди, йодиди), тіоціанати.
Адсорбційні індикатори є слабкими кислотами:
Аніони таких індикаторів здатні адсорбуватися на поверхні осадів поблизу точки еквівалентності, утворюючи міцели, та змінювати забарвлення розчину, що дозволяє визначити кінцеву точку титрування. Як такі індикатори найчастіше застосовують еозин, флуоресцеїн, дихлорофлуоресцеїн.
Титрування проводиться у різних діапазонах pH, в залежності від використовуваного індикатору: з флуоресцеїном про pH 7—10 визначають Cl-, Br-, I-, SCN-, з еозином при pH = 2 визначають Br-, I-, SCN- (хлориди не визначають через передчасну зміну забарвлення осаду — до досягнення кінцевої точки титрування).
Осад повинен мати максимально можливу поверхню, для чого у досліджуваний розчин додають колоїдні сполуки: крохмаль, декстрин.
Зворотнє визначення тіоціанатів за методом Фольгарда є окремим випадком тіоціанатометрії — кількісного визначення сполук, що утворюють осади при взаємодії з тіоціанат-іонами. За допомогою цього методу визначають галогеніди.
До розчину галогенідів у відомому надлишку додається розчин нітрату срібла, а частина, що не прореагувала відтитровується стандартним розчином тіоціанату (KSCN або NH4SCN):
Кінцева точка титрування визначається з розчином солі Мора NH4[Fe(SO4)2]·12H2O або нітрату заліза(III) Fe(NO3)3: після повного відтитровування катіонів срібла, тіоціанат-іони взаємодіють з катіонами Fe3+ із забарвленням розчину над осадом у червоний колір:
- Титрування проводиться у кислому середовищі для запобігання гідролізу сполук Fe3+; розчин підкислюють нітратною кислотою концентрацією 0,4—0,6 моль/л.
- Визначенню заважають іони Hg22+, які так само утворюють осад із тіоціанатами; також флуорид-іони, які взаємодіють із катіонами Fe3+:
- Осад AgSCN здатен адсорбувати на своїй поверхні іони Ag+, що може вплинути на результати титрування. Для уникнення цього визначення проводять при сильному перемішуванні.
- При визначенні йодидів можливий перебіг реакції відновлення заліза(III):
- ,
- тому індикатор додається наприкінці титрування.
- При визначенні хлоридів можлива обмінна реакція:
- Для запобігання контакту частинок хлориду срібла та тіоціанат-іонів, до розчину додають 1—2 мл тетрахлорометану, хлороформу або нітробензену.
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Болотов В. В., Свєчнікова О. М., Колісник С. В., Жукова Т. В. та ін. Аналітична хімія / За ред. В. В. Болотова. — Х. : Вид-во НФаУ, 2004. — С. 254-261. — ISBN 966-615-219-3.
- Пятницкий И. В., Сухан В. В. Аналитическая химия серебра. — М. : Наука, 1975. — С. 78-79. (рос.)
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)
- АРГЕНТОМЕТРІЯ [Архівовано 10 березня 2016 у Wayback Machine.] // Фармацевтична енциклопедія











![{\displaystyle \mathrm {3SCN^{-}+Fe^{3+}\rightleftarrows [Fe(SCN)_{3}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/543e66f17614490f3eec4cb9fe29c608c0770c4d)
![{\displaystyle \mathrm {Fe^{3+}+6F^{-}\longrightarrow [FeF_{6}]^{3-}\downarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a2930f51e9196c87cbaf82ebae05ae12152ccfb)

