Синильна кислота
| Синильна кислота | |
|---|---|
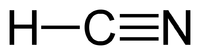
| |

| |
| Ідентифікатори | |
| Номер CAS | 74-90-8 |
| Номер EINECS | 200-821-6 |
| KEGG | C01326 |
| Назва MeSH | D01.029.260.330 і D01.625.400 |
| ChEBI | 18407 |
| RTECS | MW6825000 |
| SMILES | C#N[1] і [H+].[C-]#N |
| InChI | InChI=1S/CHN/c1-2/h1H |
| Номер Бельштейна | 1718793 |
| Властивості | |
| Молярна маса | 27,0253 г/моль |
| Зовнішній вигляд | безбарвний газ або безбарвна легколетка рідина |
| Густина | 0,687 г/см3 |
| Тпл | −13,4 °C |
| Ткип | 26,7 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |

Сини́льна кислота́, ціані́дна кислота́ також ціанід водню — кислота із хімічною формулою HCN. Безбарвна, прозора, дуже летка рідина. Пара її в звичайному стані безбарвна, має своєрідний п'янкий запах (гіркого мигдалю). Добре змішується з водою. Дуже токсична.
Температура кипіння +26,0 °С, замерзання –10,50 °С, питома вага — 0,7, густина пари в повітрі — 0,94, леткість при 20,50 °С — 873 г/м³, з водою змішується в довільних співвідношеннях, добре сорбується пористими речовинами, добре розчинюється в жирах.
Цей розділ потребує доповнення. |
В лабораторних умовах синильна кислота може бути отримана з червоної кров'яної солі та розведеної кислоти:[2]
При взаємодії з лугами синильна кислота дає ціаніди, які є більш токсичними і стійкими сполуками.
- HCN + KOH(NaOH) → KCN(NaCN) + H2O
Взаємодія з хлором призводить до утворення хлорціану, який теж має високу токсичність:
- HCN + Cl2 → CNCl + HCl
З цього випливає, що проведення дегазації синильної кислоти недоцільно. Із солями дво- і тривалентного заліза утворює берлінську лазур — ціанисту сіль заліза синього кольору, яка малорозчинна у воді: KFe+3[Fe+2(CN)6].
Реакція може використовуватись для індикації отруйної речовини. Окислювачі синильну кислоту переводять у малотоксичну ціанову кислоту. Цю властивість можна використовувати для хімічної обробки ран.
Із сірковмісними речовинами (тіосульфат натрію) синильна кислота утворює тіоціанати, а з альдегідами і кетонами (глюкоза) — ціангідрини.
- НCN + S → НSCN (тіоціанатна кислота)
Ці сполуки є малотоксичними і ця властивість закладена в основу виготовлення антидотів. Ціаніди легко вступають у реакції комплексоутворення із солями важких металів, наприклад із сульфатами заліза і міді, що використовується при виготовленні хімічного поглинача в сучасних фільтрувальних протигазах.
Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Фізичні властивості синильної кислоти зумовлюють шляхи проникнення отрути до організму. Головний шлях є інгаляційний, тобто у разі застосування синильної кислоти можливі ураження, якщо не застосовувати протигазу. Небезпечними для людини є пара синильної кислоти в концентрації 0,1–0,12 г/м³, яка при експозиції 15–20 хв. спричиняє важке ураження. Смертельними вважаються концентрації:
- 0,2–0,3 г/м³ при експозиції 5–10 хв.;
- 0,4–0,8 г/м³ при експозиції 2–5 хв.
Вони призводять до швидкої смерті.
При отруєнні через рот смертельними дозами для синильної кислоти є 1 мг/кг, ціаніду калію — 2,5 мг/кг, ціаніду натрію — 1,8 мг/кг.
Симптоми: судоми, різкий ціаноз шкіри та слизових оболонок. Через декілька хвилин настає смерть від зупинки дихання. При дії менших доз з'являються різкий головний біль, нудота, блювання, біль у животі. Зростає загальна слабкість, задишка, серцебиття, судоми; втрата свідомості. Смерть настає через декілька годин при явищах гострої серцево-судинної недостатності та зупинки дихання.
Невідкладна допомога: інгаляція ізоамілнітриту (2–3 ампули)(часто називають амілнітритом), при передозуванні пошкоджує більше гемоглобіну ніж потрібно для реактивації виведених з ладу ферментів клітинного дихання), промивання шлунку через зонд розчином перманганату калію (1:1000) або 2,5 % розчином тіосульфату натрію. В/в повільно натрію нітрит (10 мл 1 % розчину); під шкіру ефедрин, кордіамін; в/в тіосульфат натрію (50 мл 30 % розчину), метиленовий синій (50 мл 1 % розчину), глюкоза (40 мл 40 % розчину). Оксигенотерапія.
- ↑ hydrogen cyanide
- ↑ Basset H., Corbet A. S. CLXXI. — The hydrolysis of potassium ferricyanide and potassium cobalticyanide by sulphuric acid // Journal of the Chemical Society. Transactions. — 1924. — 5 листопада. — С. 1358—1366. — DOI:. (англ.)
- КИСЛОТА ЦІАНІДНА [Архівовано 16 березня 2016 у Wayback Machine.] // Фармацевтична енциклопедія
- http://likar.org.ua/content/view/6337/432/lang,uk/ [Архівовано 23 квітня 2018 у Wayback Machine.]
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
![{\displaystyle {\mathsf {K_{3}[Fe(CN)_{6}]+6HCl{\xrightarrow {}}\ 3KCl+FeCl_{3}+6HCN{\uparrow }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f4a0e0476d4fbffaffa94c262693676d88e826d)
