Ізопропіловий спирт
| Ізопропіловий спирт | |
|---|---|
 ізопропіловий спирт
|
 ізопропанол
|
| Назва за IUPAC | пропан-2-ол |
| Інші назви | 2-пропанол, ізопропанол |
| Ідентифікатори | |
| Номер CAS | 67-63-0 |
| PubChem | 3776 |
| Номер EINECS |
200-661-7 |
| DrugBank |
DB02325 |
| KEGG |
D00137 і C01845 |
| Назва MeSH |
D02.033.755.615 |
| ChEBI |
17824 |
| RTECS | NT8050000 |
| Код ATC |
D08AX05 |
| SMILES | CC(O)C |
| InChI |
InChI=1S/C3H8O/c1-3(2)4/h3-4H,1-2H3 |
| Номер Бельштейна |
635639 |
| Номер Гмеліна |
1464 |
| Властивості | |
| Молекулярна формула | C3H8O1 |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,786 г/см³ (20 °C) |
| Тпл | −98,5 °C |
| Ткип | 82,4 °C |
| Розчинність (вода) | повна змішуваність |
| Розчинність | повна змішуваність з бензеном, хлороформом, етанолом, ефіром, гліцерином нерозчинний в сольових розчинах |
| Розчинність (ацетон) | розчинний |
| Кислотність (pKa) | 16,5 |
| Показник заломлення (nD) | 1,37723 |
| В'язкість | 2,86 кПуаз при 15 °C 1,96 кПуаз при 25 °C[1] 1,77 кПуаз при 30 °C |
| Дипольний момент | 1,66 (газ) |
| Небезпеки | |
| ЛД50 | 5005 мг/кг (пацюки, орально) |
| MSDS | External MSDS |
| Головні небезпеки | схильний до самозаймання |
| NFPA 704 | |
| Температура спалаху | 11,7 °C (у відкритій посудині) 13 °C (у закритій посудині) |
| Температура самозаймання | 399 °C |
| Пов'язані речовини | |
| Інші (спирти) | пропіловий спирт (ізомер), етанол, 2-бутанол |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ізопропі́ловий спирт (2-пропанол, пропан-2-ол, ізопропанол, диметилкарбінол) CH3CH(OH)CH3 — найпростіший вторинний одноатомний спирт аліфатичного ряду. Належить до речовин 3-го класу небезпеки (помірно небезпечні речовини) за ступенем впливу на організм, має наркотичну дію. Гранично допустима концентрація (ГДК) для випарів ізопропанолу в повітрі становить 10 мг/м³. Отруєння ізопропіловим спиртом настає внаслідок вдихання випарів, що містять концентрацію, яка перевищує ГДК, кумулятивних властивостей не має[2]. Споживання навіть у невеликих дозах викликає отруєння. Широко використовується як розчинник у промисловості й як технічний спирт у засобах для чищення скла, оргтехніки та ін.
Товарний ізопропанол містить від 91 до 99,5% спирту. Технічні умови для цього продукту не встановлені, через що препарат, який надходить на продаж, за складом може відповідати навіть азеотропній суміші з водою. Ступінь чистоти спирту може коливатися в широких межах залежно від способу його одержання й використаної сировини.
Ізопропіловий спирт відкрив 1855 року М. Бертло під час обробки пропілену концентрованою сірчаною кислотою й розкладання продукту реакції водою[3].

Ізопропіловий спирт розчинний у воді, етанолі, етерах і хлороформі. Розчиняє етилцелюлозу, полівінілбутирал, багато масел, алкалоїди, ґуми й природні смоли[4]. Нерозчинний у розчинах солей. На відміну від етанолу чи метанолу, ізопропіловий спирт можна виділити з водного розчину додаванням неорганічної солі, зокрема хлориду чи сульфату натрію[5].
Ізопропіловий спирт з водою утворює азеотроп з точкою кипіння 80,37 °C і часткою спирту 87,7% мас. (91% об.). Водно-спиртова суміш здатна знижувати температури плавлення[5].
Зі зниженням температури зростає в'язкість ізопропанолу. При температурі нижче −70 °C ізопропіловий спирт за в'язкістю нагадує кленовий сироп.
У невеликих кількостях ізопропіловий спирт, поряд з бутанолом, отримують при бродінні вуглеводів[6][7][8]
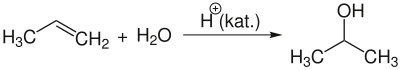
Основний спосіб отримання ізопропанолу в промисловості — через непряму гідратацію пропілену сірчаною кислотою (CH3CHCH2 + H2O).
Сировиною зазвичай служить пропан-пропіленова суміш газів крекінгу або пропіленова суміш газів піролізу нафти. При цьому процесі можливі наступні хімічні реакції взаємодії пропілену з сульфатною кислотою і водою:
Ізопропілсульфат реагуючи з пропіленом, дає диізопропілсульфат:
Диізопропілсульфат при реакції з водою знову утворює ізопропілсульфат та ізопропіловий спирт:
Крім того, ізопропанол реагує з диізопропілсульфатом з утворенням диізопропілового етеру і ізопропілсульфату:

Численні дослідження гідратації пропілену сульфатною кислотою призвели до виникнення двох різних методів:
- методу концентрованої кислоти;
- методу розбавленої кислоти.
Гази стабілізації з крекінг-установок із вмістом пропілену 20—24% спочатку відмивають у скруберах від сірководню[9][10]. Потім видаляють вищі вуглеводні фракційною перегонкою і концентрують пропілен до мінімум 50%. Абсорбцію пропілену можна істотно поліпшити за допомогою абсорбційної олії, більшою частиною газойля. Абсорбційна олія полегшує переробку низькоконцентрованого пропілену. Крім того, воно значно знижує схильність до полімеризації при використанні висококонцентрованого пропілену.

Абсорбція проводиться протитоком в екстракційній колоні з 8 тарілками під тиском 8—10 кгс/см² у 92%-ній сульфатній кислоті при 20 °С. На кожній тарілці є шар абсорбційного масла. Після екстракції тиск сульфатної кислоти знижують, у відстійнику відділяється екстракційне масло і знову подається в колону. Екстракт містить близько 1,1—1,3 моль С3Н6/моль H2SO4. Витрата кислоти становить ~12 кг на 10 л 100%-ного ізопропілового спирту, витрата пропілену — близько 39 м³ (теоретично — 32 м³).
Температура на окремих тарілках екстракційної колони не повинна перевищувати 20 °С, інакше можливі значні втрати пропілену через полімеризацію.
З відстійника екстракт надходить у освинцьований реакційний апарат з турбомішалкою, де розбавляється водою до отримання 40%-ного розчину, протягом приблизно 1 год при 50 °С. Після 4-годинного перебування в апараті без перемішування спирт і утворений диізопропіловий етер екстрагуються водяною парою. Пари спирту й етеру промиваються 1% розчином їдкого натру. Після розведення водою до концентрації 15% конденсат витримують кілька днів для відокремлення полімеру. При ректифікації спочатку виділяють ~2% легко киплячих компонентів, у другій колоні ізопропіловий спирт концентрують до 91,3%-ної азеотропної суміші, що кипить при 80,4 °С. Вихід ізопропілового спирту становить 85—90% у відношенні до початкового пропілену.
Для отримання безводного ізопропілового спирту азеотропну суміш зневоднюють бензеном або диізопропіловим етером, рідше — діетиловим етером. Головний продукт, який перебуває в збірнику розділений на 2 шари, частково повертається у верхню частину колони (верхній шар з ізопропілового спирту і бензену), частково подається в колону для концентрації (нижній шар з водного ізопропілового спирту) для регенерації залишків ізопропілового спирту й бензену. Безводний ізопропанол (>99%) відганяється знизу колони.
Всі деталі апаратів, які контактують з розведеною сульфатною кислотою виготовляються або зі свинцю, або з міді. Після промивання 1% розчином їдкого натру сталь — найбільш придатний матеріал для виготовлення ємностей, труб і колон.

За методом розведеної кислоти пропілен абсорбується під тиском 25 кгс/см² при 65 °С в 70%-ній сульфатній кислоті. При цьому диізопропілсульфат не утворюється, а ізопропіловий спирт отримують відразу без подальшого розведення водою[11][12].
В абсорбційну безтарільчату колону, заповнену 70%-ною сульфатною кислотою, нагнітається попередньо компримований крекінг-газ, що містить пропілен. Сульфатна кислота поглинає 1 моль С3Н6 на моль H2SO4. Крекінг-газ із початковим вмістом пропілену близько 20-25% абсорбується до залишкового вмісту 5—6%.
Залишковий газ екстрагується в колоні з ковпачковими тарілками свіжою 70%-ною сульфатною кислотою, яка виходить з колони для омилення, до залишкового вмісту пропілену 1%. Потім сульфатна кислота з 0,2% пропілену проходить через безтарільчату колону. У відгонній колоні й колоні для омилення до суміші сульфатної кислоти та ізопропілсульфату додається вода до одержання 60%-ного розчину, а ізопропілсульфат омилюється. 85%-ний ізопропіловий спирт відганяється. З низу колони виводиться 70%-на сульфатна кислота, яку можна відразу застосовувати для наступного циклу.
Класичний метод отримання ізопропілового спирту в рідкій фазі має деякі недоліки. Так, втрати кислоти досить значні, а витрати на її регенерацію істотні. Крім того, великі труднощі викликає корозія устаткування. Тому було здійснено численні досліди з прямого приєднання води до олефінів на нерухомому шарі каталізатора. У результаті було розроблено метод гідратації етилену із застосуванням фосфатної кислоти на цеоліті (кизельгур).
Реакція безпосереднього перетворення олефінів у спирт є рівноважною, перебігу реакції сприяють низька температура, високий тиск і високе співвідношення пара: олефіни.
З багатьох можливих каталізаторів реакції прямої гідратації олефінів для промислового застосування рекомендовано тільки два[джерело?]:
- фосфатна кислота на носії;
- оксид вольфраму з промотором.
Ізопропіловий спирт можна отримати каталітичною гідратацією пропілену за наявності сульфатної кислоти. Максимальний вихід спирту (67%) було досягнуто використанням 99%-ної сульфатної кислоти при 15 °С. При 100 °С і використанні 85%-ної кислоти погано поглинаються навіть невеликі кількості пропілену[13].
Гідратація пропілену також можлива за наявності оксиду вольфраму. У цьому методі спостерігається вищий вихід спирту й утворюється менша кількість полімерів, ніж у попередньому. У тих випадках, коли каталізатори таблетовані при тиску 104 кг/см², конверсія при 250 °С становила 16%. Якщо ж таблетування проводили при тиску 5·103 кг/см², то конверсія при цій же температурі становила лише 10%[14].
Очищають ізопропіловий спирт, отриманий з таких олефінів, як пропілен, обробляючи його спочатку водним розчином їдкого натру, а потім піддаючи багаторазовій перегонці. Перед останньою перегонкою спирт стабілізують і позбавляють від стороннього запаху, додаючи невелику кількість хлориду міді (0,5% або менше)[15].
Безводний ізопропіловий спирт отримують, насичуючи водну суміш амоніаком і діоксидом вуглецю. При цьому утворюються два шари. Шар, що містить більшу кількість води, переганяють, отримуючи амоніак, діоксид вуглецю і азеотропну суміш. Шар із меншим вмістом води також піддають фракційній перегонці з отриманням азеотропу й безводного спирту[16]
Товарний продукт очищають, осушуючи його над магнієвою стрічкою й піддаючи фракційній перегонці у колонці Дафтона висотою 180 см. Найчистіша фракція кипить при 82,33 — 82,39 °С[17].
Ще один метод очищення ізопропанолу полягає в його осушуванні спочатку над хлоридом кальцію, а потім — над оксидом барію. Після цього його тричі піддають ретельній фракційній перегонці[18].
«Абсолютний» ізопропіловий спирт можна отримати перегонкою в ефективній колонці над свіжогашеним вапном. Фракцію, що кипить при 82—82,4 °С, збирають і струшують протягом 2 днів з безводним сульфатом міді, після чого переганяють кілька разів до досягнення постійної температури кипіння. Отриманий таким способом спирт містить менше 0,10% води[19].
Ще один спосіб отримання чистого ізопропанолу полягає в його сушінні над магнієм і перегонці над сульфаніловою кислотою[20].
Існує й швидкий метод отримання безводного ізопропілового спирту. Товарний 91%-ний спирт струшують з водним розчином їдкого натру (взятим у кількості 10% від маси спирту), після чого відокремлюють від водного розчину, знову струшують з великою кількістю розчину гідроксиду натрію, декантують і переганяють. Якщо змішати отриманий таким чином продукт з 8 об'ємами сірковуглецю, ксилену або петролейного ефіру, то при цьому не буде спостерігатися навіть незначного помутніння[21].
Водний розчин ізопропанолу можна сконцентрувати струшуванням з хлоридом натрію. Верхній шар містить близько 87% пропанолу-2 і 2—3% хлориду натрію. Перегонка дає 91%-ну азеотропну суміш.
Ізопропіловий спирт окиснюється до відповідного кетону — ацетону. Окисним агентом у цьому процесі може виступати хромова кислота.
Також ацетон з ізопропанолу можна отримати дегідрогенізацією на нагрітому мідному каталізаторі:
Ізопропіловий спирт використовується одночасно і як розчинник, і як реагент у реакції Меєрвейна-Пондорфа-Верлея та інших процесах, пов'язаних із переміщенням гідрогену. За допомогою триброміду з ізопропанолу можна отримати 2-бромопропан, а в результаті процесу дегідратації при нагріванні за наявності сульфатної кислоти, утворюється пропілен.
Як і більшість спиртів, ізопропіловий спирт взаємодіє з активними металами (зокрема, з натрієм), утворюючи алкоголяти:
Реакція з алюмінієм (ініційована незначною кількістю ртуті) застосовується для приготування каталізатора — алкоголяту алюмінію[22].
З типових для спиртів реакцій, можна навести взаємодії ізопропілового спирту з:
- амідами металів
- ацетиленідами металів

Основна кількість ізопропілового спирту використовується для отримання ацетону, однак вона зменшується через серйозну конкуренцію з боку кумольного методу виробництва ацетону.
Ізопропіловий спирт поширений як розчинник для жирів, натуральних і синтетичних смол, нітролаків (у поєднанні з іншими розчинниками), алкалоїдів, протеїнів, хлорофілу та інших речовин. Він використовується і як складова частина детергентів (рідкі мила).
Поряд із застосуванням для синтезу ацетону ізопропіловий спирт використовують для синтезу різних складних ефірів (естерів) (наприклад, ізопропілацетату — розчинника лаків), для введення ізопропілової групи в інші сполуки (тимол, ізопропілфенол). Ксантогенат ізопропілового спирту є важливим флотаційним агентом. Ізопропілати алюмінію застосовують для відновлення альдегідів за методом Меєрвейна-Понндорфа.
Ізопропіловий спирт замінює етиловий у багатьох косметичних та фармацевтичних препаратах. Але він придатний лише для зовнішнього застосування, наприклад дезінфекції. Застосування його для ліків і харчових продуктів заборонене.
У великій кількості ізопропіловий спирт використовується для поліпшення якості пального як паливна присадка. У карбюраторі двигуна за температури від −8 до +13 °С і відносної вологості повітря 60-100% може настати обмерзання, що ускладнює запуск і вимкнення двигуна. Для усунення цього небажаного явища досить додати до бензину 1,5-3% ізопропілового спирту.
Ізопропіловий спирт використовують для запобігання обледенінню крил і пропелерів літаків, а суміш етиленгліколю та ізопропілового спирту усуває обледеніння стартових доріжок та злітно-посадкових смуг на аеродромах.
Також він може використовуватися для усунення неприємного запаху у взуття, для чого необхідно протерти вмоченим в ньому ватним тампоном внутрішню частину взуття.
Подразнює очі й дихальні шляхи, при короткому впливі великих концентрацій пари викликає головний біль. Може пригнічувати центральну нервову систему. Вплив на рівні, що значно перевищує ГДК, може викликати непритомність. Ізопропанол при прийомі всередину метаболізується в печінці під дією алкогольдегідрогенази в ацетон, що спричиняє його незначну токсичну дію. Невеликі дози ізопропанолу, як правило, не викликають значних розладів. Серйозний токсичний вплив на здорову дорослу людину при пероральному вживанні може бути досягнутий вже при дозах близько 50 мл і більше.
Гранично допустима концентрація ізопропанолу в повітрі дорівнює 10 міліграмів на кубічний метр.
Ізопропанол органолептично помітно відрізняється від етанолу і не може бути помилково сплутаний з останнім. Має відмінний від етанолу, «грубіший» запах. У разі вживання викликає сп'яніння, схоже з алкогольним. Швидкість окиснення ізопропанолу в організмі людини в середньому в 2—2,5 разів нижча, ніж в етанолу, тому сп'яніння ізопропанолом дуже стійке. При частому вживанні до ізопропанолу швидко розвивається непереносимість, а в окремих випадках — гіперчутливість та алергія.
Смертельних отруєнь ізопропанолом не зафіксовано, оскільки людина впадає в алкогольний транс набагато раніше, ніж зможе самостійно вжити смертельну дозу ізопропанолу.
- ↑ Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill.
- ↑ ГОСТ 9805-84. Спирт изопропиловый. Технические условия. Архів оригіналу за 16 червня 2015. Процитовано 4 листопада 2012. [Архівовано 2015-06-16 у Wayback Machine.]
- ↑ М. Berthelot, Ann. Chim. et phys., 43, № 3, 391 (1855).
- ↑ Doolittle, Arthur K. (1954). The Technology of Solvents and Plasticizers. New York: John Wiley & Sons, Inc.. p. 628.
- ↑ а б The Merck Index (10th ed.). Rahway, NJ: Merck & Co.. 1983. p. 749.
- ↑ Патенти США 1725083, 1927 та 2420998, 1947.
- ↑ Англійські патенти 293015, 1928 та 401284, 1932.
- ↑ Французький патент 743530, 1932.
- ↑ F. Asinger, Chemie und Technologie der Monoolefine, Berlin, 1957, S. 581–584.
- ↑ I. G. Park, С. М. Beamer, in Kirk — Othmer, Encyclopedia of Chemical Technology, v. 11, N. Y., 1953, p. 185–187.
- ↑ Патент США 2473224, 1949.
- ↑ W. Н. Shiffler et al., Industrial & Engineering Chemistry, 31, 1101 (1939).
- ↑ Itakura T., Journal of the Chemical Society of Japan, 63, 1400 (1942).
- ↑ Reynolds P.W., Grudgings D.M., англійський патент 622937, травень 10, 1949
- ↑ Ozol R.J., Masterson C.R., патент США 2356689, серпень 22, 1944.
- ↑ Frejacques J. L. M., патент США 2461048, лютий 8, 1949.
- ↑ Maryott A. A., Journal of the American Chemical Society, 63, 3079 (1941).
- ↑ Mathews J. H., Journal of the American Chemical Society, 48, 562 (1926).
- ↑ Lebo R. B., Journal of the American Chemical Society, 43, 1005 (1921)
- ↑ Herold W., Wolf K. L., Zeitschrift für Physikalische Chemie, 12B, 194 (1931).
- ↑ Gilson L. E., Journal of the American Chemical Society, 54, 1445 (1932)
- ↑ Young, W.; Hartung, W.; Crossley, F. (1936). «Reduction of Aldehydes with Aluminum Isopropoxide». J. Am. Chem. Soc. 58: 100-2.
- Маслій Ю.С. Стаття про ізопропіловий спирт у "Фармацевтичній енциклопедії". Архів оригіналу за 22 червня 2013.
- Стаття про ізопропіловий на сайті "Хімік" (рос.) . Архів оригіналу за 22 червня 2013.
- Гончаров А., І., Корнілов М., Ю. Довідник з хімії. — Київ : Вища школа, 1974. — 306 с.
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э. Органические растворители. — Москва : Издательство иностранной литературы, 1958. — 521 с. (рос.)
- Samir Zakhari,. Isopropanol and ketones in the environment. — Каліфорнійський університет : CRC Press, 1977. — 147 с. — ISBN 9780849351976. (англ.)
| Ця сторінка належить до добрих статей української Вікіпедії. |








![{\displaystyle \mathrm {2CH_{3}CH(OH)CH_{3}+O_{2}{\xrightarrow[{2,5-3,5\;bar}]{500^{o}C}}\ 2CH_{3}COCH_{3}+2H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/560840b0a4c3dc6151c7dae188c6c026163c0d9b)

![{\displaystyle \mathrm {CH_{3}CH(OH)CH_{3}{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}\ CH_{3}CH{=}CH_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/29f89ad051261f2956b4962205d529a06b2e3fa3)









