Клітини Сертолі
| клітини Сертолі | |
|---|---|
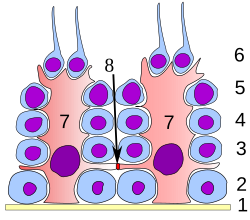 Сперматогенний епітелій. 1: базальна пластинка 2: сперматогонії 3: сперматоцит 1-го порядку 4: сперматоцит 2-го порядку 5: сперматида 6: зріла сперматида 7: Клітина Сертолі 8:гемато-тестикулярний бар'єр. | |
 Гістологічний зріз через тестикулярну перенхіму кабана. 1 сімяні канальці Tubulus seminiferus contortus 2 сперматиди 3 сперматоцити 4 Сперматогонії 5 клітини Сертолі 6 Міофібробласти 7 клітини Лейдігаs 8 капіляри | |
| Ідентифікатори | |
| Анатомія Грея | subject #258 |
| MeSH | D012708 |
| FMA | 72298 |
| Анатомічна термінологія | |
Клітини Сертолі (син. сустентоцити, підтримуючі клітини) — соматичні клітини, розташовані в звивистих канальцях сім'яників ссавців. Різновид інтерстиціальних клітин. Є частиною гемато-тестикулярного бар'єру розвиваються навколо чоловічих гамет.
Розвивається в більшості з целомічного епітелію мозкових тяжів, має світлу цитоплазму. Менша частина є похідною епітелію канальців первинної нирки і має темну цитоплазму. Кінцеву структуру набувають під дією тестостерону ближче до періоду статевого дозрівання. Клітини Сертолі продукують гормон інгібін, що пригнічує проліферацію сперматогоний, посилює синтез тестостерону і дозрівання сперматозоїдів з сперматогоній.
Оскільки їх головна функція полягає в тому, щоб живити сперматозоїди, що розвиваються, клітина Сертолі також називалася клітиною «мати» або «медсестра»[1]. Клітини Сертолі також діють як фагоцити, споживаючи залишкову цитоплазму під час сперматогенезу. Транслокація клітин від тіла до просвіту сім'яних канальців відбувається шляхом конформаційних змін бічних країв клітин Сертолі.
Клітини сертолі виділяють такі речовини:
- анти-Мюллерівський гормон (АМГ) — секретується на ранніх стадіях життя плоду.
- інгібін і активін — секретуються після статевого дозрівання і працюють разом, щоб регулювати секрецію ФСГ.
- андроген-зв'язуючий білок (також званий тестостерон-зв'язуючий глобулін) — підвищує концентрацію тестостерону в сім'яних канальцях, щоб злегка стимулювати сперматогенез.
- естрадіол — ароматаза з клітин Сертолі перетворює тестостерон у 17 бета-естрадіол до прямого сперматогенезу
- Доведено, що нейротрофічний фактор (GDNF) з гліальних клітин сприяє недиференційованій сперматогонії, що забезпечує самовідновлення стовбурових клітин протягом перинатального періоду.
- ETS Related Molecule або транскрипційний фактор ERM — необхідний для підтримки сперматогоніальних стовбурових клітин у дорослих яєчках.
- трансферин — білок плазми крові для доставки іонів заліза[2]
Оклюзійні сполуки клітин Сертолі утворюють гематотестикулярний бар'єр, структуру, яка розділяє інтерстиціальний відділ яєчка з адлюмінальним відсіком сім'яних канальців. Внаслідок апікальної прогресії сперматогонії (сперматозоїдні клітини) оклюзійні переходи повинні бути динамічно реформовані і розбиті, щоб дозволити імуноідентичній сперматогонії перетнути гематотестикулярний бар'єр, щоб вони могли стати імунологічно унікальними. Клітини Сертолі контролюють надходження і викид поживних речовин, гормонів та інших хімічних речовин до канальців яєчка, а також роблять адлюмінальний відсік привілейованим сайтом.
Клітина також відповідає за встановлення і підтримку сперматогоніальної ніші стовбурових клітин, яка забезпечує відновлення стовбурових клітин і диференціювання сперматогонії в зрілий зародок, що відбувається через тривалий процес сперматогенезу, закінчуючись вивільненням сперматозоїдів. Клітини Сертолі зв'язуються зі сперматогоніальними клітинами через N-кадгерини і галактозилтрансферази (через вуглеводні залишки).
Під час фази дозрівання сперміогенезу, клітини Сертолі споживають непотрібні частини сперматозоїдів.
Клітини Сертолі здатні відновити пошкодження ДНК. Ця репарація, ймовірно, відбувається шляхом гомологічного з'єднання кінців, у який залучені білки XRCC1 і PARP1, експресовані в клітинах Сертолі[3].
Клітини Сертолі мають більш високу частоту мутацій, ніж сперматогонії. У порівнянні з сперматоцитами частота мутацій у клітинах Сертолі приблизно в 5-10 разів вище. Це може бути пов'язаним з необхідністю більш ефективної репарації ДНК, ніж у соматичних клітинах для уникнення мутацій у зародковій лінії.
Окрім вираження факторів, важливих для дозрівання сперматозоїдів, клітини Сертолі виробляють широкий спектр молекул (або на їх поверхні, або на розчинних), які здатні модифікувати імунну систему (ІС). Здатність клітин Сертолі змінювати імунну відповідь в канальцях необхідна для успішного дозрівання клітин сперми. Сперматозоїди експресують неоепітопи на своїй поверхні, коли вони проходять через різні стадії дозрівання. Вони можуть викликати сильний імунну відповідь, якщо їх помістити в іншу ділянку тіла.
Молекули, що продукуються клітинами Сертолі, пов'язані з імуносупресією або иммунорегуляцієй
[ред. | ред. код]Система FAS / FAS-L — експресія ліганду Fas (Fas-L) на поверхні SCs активує апоптотичну смерть Fas-несучих клітин Fas. цитотоксичні Т-клітини[4].
- розчинний FasL — підвищення ефективності системи
- розчинна Fas- FasL блокада на поверхні інших клітин (немає індукції апоптозу в клітинах Сертолі клітинами IS)
B7 / H1 — зменшення проліферації ефекторних Т-клітин[5]
Jagged1 (JA#G1) — індукція експресії транскрипційного фактора Foxp3 в наївних Т-лімфоцитах (збільшення відносної кількості регуляторних клітин Т)[6]
Інгібітор протеази-9 (PI-9) — член сімейства serpin (інгібітори серинових протеаз)[7]
- індукує секрецію протеази B, цитотоксичні T-клітини і NK-клітини здатні індукувати апоптоз в клітині-мішені. SCs продукують PI-9, що необоротно зв'язує Granzyme B і інгібує його активність
CD59 — поверхнева молекула на СК, член регуляторних протеїнів комплементу (CRP)
- інгібує останній крок каскаду комплементу — формування мембранного комплексу Atack [10]
Кластерин — розчинна молекула, функція, подібна до CD59 — комплексу з Granyzme B і інгібує активацію апоптозу Т-лімфоцитами або NK-клітинами[8]
TGF-бета — трансформує фактор росту бета (його пряме виробництво SCs є спірним)
- індукція регуляторних Т-клітин на периферії[9]
Участь у синтезі інших молекул
CD40 — молекула, асоційована з дендритними клітинами (DC)
- СК здатні регулювати експресію CD40 на поверхні ДК (механізм невідомий)
- Зниження регуляції CD40 призводить до зниження здатності ДК стимулювати Т-клітинну відповідь[8]
Клітини Сертолі також здатні інгібувати міграцію імунних клітин — зниження інфільтрації імунних клітин до місця запалення.
Клітини сертолі необхідні для чоловічого статевого розвитку. Під час розвитку чоловіка ген SRY активує SOX9, який потім активує і утворює пряму петлю з FGF9. Проліферація і диференціація клітин Сертолі в основному активується FGF9[10]. Відсутність FGF9 створює тенденцію до розвитку жінки[11].
Після повної диференціації клітина Сертолі вважається кінцево диференційованою і не може проліферувати. Тому, як тільки сперматогенез почався, більше не створюються клітини Сертолі.
Нещодавно, однак, деякі вчені знайшли спосіб індукувати клітини Сертолі до ювенільного проліферативного фенотипу поза тілом[12]. Це дає можливість усунути деякі дефекти, що викликають чоловіче безпліддя.
Було висловлено припущення, що клітини Сертолі можуть походити з плодового мезонефроса[13].
Клітини Сертолі називаються так через епонім Енріко Сертолі, італійський фізіолог, який відкрив їх під час вивчення медицини в університеті Павії, Італія.
У публікації 1865 року в його першому описі використовувалися терміни «деревоподібна клітина» або «клітинка, що волочила», і найголовніше він називав їх «материнськими клітинами». Саме інші вчені, які використовували прізвище Енріко, Сертолі, позначали ці клітини в публікаціях, починаючи з 1888 року. З 2006 року були опубліковані два підручники, спеціально присвячені клітині Сертолі.
На предметних скельцях, використовуючи стандартне фарбування, клітини Сертолі можуть легко плутати з іншими клітинами зародкового епітелію. Найбільш відмітною особливістю клітини Сертолі є темне ядро.
Клітинна пухлина Сертолі-Лейдіга є частиною групи пухлин-строми яєчників.
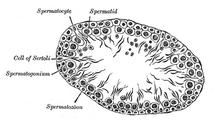
Нещодавно експериментальні моделі аутоімунних запальних розладів, включаючи діабет, підштовхнули клітини Сертолі до трансплантації клітинної терапії завдяки їх імунорегуляторним та протизапальним властивостям.
Дослідження, в яких клітини Сертолі використовуються в лікуванні діабету типу I., зараз проводяться дуже активно. Стратегія полягає в котрансплантації клітин β разом з клітинами Сертолі в організм реципієнта. У випадку мишей і щурів відновлюється гомеостаз глюкози разом з більш низькою потребою зовнішнього інсуліну. У всіх випадках не застосовувалася імуносупресія, роль цього препарату була надана СК[14][15][16].
Лікування мишей з діабетом і ожирінням за допомогою трансплантації мікрокапсульованих клітин Сертолі в підшкірному абдомінальному жировому депо, Джованні та ін[17]. продемонстрували, що більше половини оброблених мишей показали покращений гомеостаз глюкози. Ця остання наукова робота обіцяє в майбутньому краще лікування пацієнтам з цукровим діабетом 2 типу за допомогою клітинної терапії.
Клітини Сертолі сприяють прийому трансплантата шкіри реципієнтним організмом[18], а також їх присутність допомагає збільшити кількість рухових нейронів спинного мозку мишей SOD1 (мишача модель аміотрофічного латерального склерозу)[19].
Функція клітин Сертолі в амніота та анамніота однакова, але вони мають дещо інші властивості в порівнянні один з одним. Анамніонти (риби та амфібії) використовують кістозний сперматогенез для отримання клітин сперми[20]. У випадку амніота клітини Сертолі вважаються термінально диференційованими клітинами, які не здатні до проліферації. У анамніота клітини Сертолі проходять через дві проліферативні фази. Перша фаза проліферації відбувається під час створення кісти, що сприяє також міграції статевих клітин у неї[21][22] другий — розширити кісту і створити простір для проліферуючих зародкових клітин.[23]
Загальноприйнятий факт, що клітини Сертолі термінально диференційовані в амніоті, нещодавно було змінено. Після ксеногенної трансплантації клітини Сертолі змогли проліферувати.
- ↑ Rato, Luís; Alves, Marco G.; Socorro, Sílvia; Duarte, Ana I.; Cavaco, José E.; Oliveira, Pedro F. (2012-6). Metabolic regulation is important for spermatogenesis. Nature Reviews Urology (англ.). Т. 9, № 6. с. 330—338. doi:10.1038/nrurol.2012.77. ISSN 1759-4812. Архів оригіналу за 15 листопада 2020. Процитовано 19 травня 2019.
- ↑ Xiong, XianZhi; Wang, AiGuo; Liu, GuoHong; Liu, HongKai; Wang, Chong; Xia, Tao; Chen, XueMin; Yang, KeDi (2006-7). Effects of p,p′-dichlorodiphenyldichloroethylene on the expressions of transferrin and androgen-binding protein in rat Sertoli cells. Environmental Research (англ.). Т. 101, № 3. с. 334—339. doi:10.1016/j.envres.2005.11.003. Архів оригіналу за 9 травня 2019. Процитовано 19 травня 2019.
- ↑ Ahmed, Emad A.; Rijbroek, Angeliqué D. Barten-van; Kal, Henk B.; Sadri-Ardekani, Hooman; Mizrak, S. Canan; Pelt, Ans M.M. van; Rooij, Dirk G. de (1 червня 2009). Proliferative Activity In Vitro and DNA Repair Indicate that Adult Mouse and Human Sertoli Cells Are Not Terminally Differentiated, Quiescent Cells1. Biology of Reproduction (англ.). Т. 80, № 6. с. 1084—1091. doi:10.1095/biolreprod.108.071662. ISSN 0006-3363. Архів оригіналу за 27 січня 2022. Процитовано 19 травня 2019.
- ↑ Dal Secco, Valentina; Riccioli, Anna; Padula, Fabrizio; Ziparo, Elio; Filippini, Antonio (2008-2). Mouse Sertoli cells display phenotypical and functional traits of antigen-presenting cells in response to interferon gamma. Biology of Reproduction. Т. 78, № 2. с. 234—242. doi:10.1095/biolreprod.107.063578. ISSN 0006-3363. PMID 17989360. Процитовано 19 травня 2019.
- ↑ Kaur, Gurvinder; Thompson, Lea Ann; Dufour, Jannette M. (2014-6). Sertoli cells--immunological sentinels of spermatogenesis. Seminars in Cell & Developmental Biology. Т. 30. с. 36—44. doi:10.1016/j.semcdb.2014.02.011. ISSN 1096-3634. PMC PMCPMC4043859. PMID 24603046. Архів оригіналу за 5 листопада 2018. Процитовано 19 травня 2019.
{{cite news}}: Перевірте значення|pmc=(довідка) - ↑ Campese, Antonio Francesco; Grazioli, Paola; de Cesaris, Paola; Riccioli, Anna; Bellavia, Diana; Pelullo, Maria; Padula, Fabrizio; Noce, Claudia; Verkhovskaia, Sofia (2014-3). Mouse Sertoli cells sustain de novo generation of regulatory T cells by triggering the notch pathway through soluble JAGGED1. Biology of Reproduction. Т. 90, № 3. с. 53. doi:10.1095/biolreprod.113.113803. ISSN 1529-7268. PMID 24478388. Процитовано 19 травня 2019.
- ↑ Potempa, J.; Korzus, E.; Travis, J. (10 червня 1994). The serpin superfamily of proteinase inhibitors: structure, function, and regulation. The Journal of Biological Chemistry. Т. 269, № 23. с. 15957—15960. ISSN 0021-9258. PMID 8206889. Архів оригіналу за 18 квітня 2018. Процитовано 19 травня 2019.
- ↑ а б Lee, Hak-Mo; Oh, Byoung Chol; Lim, Dong-Pyo; Lee, Dong-Sup; Lim, Hong-Gook; Park, Chun Soo; Lee, Jeong Ryul (2008-6). Mechanism of humoral and cellular immune modulation provided by porcine sertoli cells. Journal of Korean Medical Science. Т. 23, № 3. с. 514—520. doi:10.3346/jkms.2008.23.3.514. ISSN 1011-8934. PMC PMCPMC2526533. PMID 18583891. Архів оригіналу за 29 січня 2012. Процитовано 19 травня 2019.
{{cite news}}: Перевірте значення|pmc=(довідка) - ↑ Iliadou, Paschalia; Tsametis, Christos; Kaprara, Athina; Papadimas, Ioannis; Goulis, Dimitrios (15 жовтня 2015). The Sertoli cell: Novel clinical potentiality. HORMONES. Т. 14, № 4. с. 504—514. doi:10.14310/horm.2002.1648. Архів оригіналу за 30 серпня 2019. Процитовано 19 травня 2019.
- ↑ Kim, Yuna; Kobayashi, Akio; Sekido, Ryohei; DiNapoli, Leo; Brennan, Jennifer; Chaboissier, Marie-Christine; Poulat, Francis; Behringer, Richard R.; Lovell-Badge, Robin (2006-6). Fgf9 and Wnt4 act as antagonistic signals to regulate mammalian sex determination. PLoS biology. Т. 4, № 6. с. e187. doi:10.1371/journal.pbio.0040187. ISSN 1545-7885. PMC PMCPMC1463023. PMID 16700629. Архів оригіналу за 4 грудня 2018. Процитовано 19 травня 2019.
{{cite news}}: Перевірте значення|pmc=(довідка)Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Moniot, B.; Declosmenil, F.; Barrionuevo, F.; Scherer, G.; Aritake, K.; Malki, S.; Marzi, L.; Cohen-Solal, A.; Georg, I. (1 червня 2009). The PGD2 pathway, independently of FGF9, amplifies SOX9 activity in Sertoli cells during male sexual differentiation. Development (англ.). Т. 136, № 11. с. 1813—1821. doi:10.1242/dev.032631. ISSN 0950-1991. PMC 4075598. PMID 19429785. Процитовано 19 травня 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Nicholls, Peter K.; Stanton, Peter G.; Chen, Justin L.; Olcorn, Justine S.; Haverfield, Jenna T.; Qian, Hongwei; Walton, Kelly L.; Gregorevic, Paul; Harrison, Craig A. (2012-12). Activin Signaling Regulates Sertoli Cell Differentiation and Function. Endocrinology (англ.). Т. 153, № 12. с. 6065—6077. doi:10.1210/en.2012-1821. ISSN 0013-7227. Процитовано 19 травня 2019.
- ↑ Vize, Peter D.; Woolf, Adrian S.; Bard, Johnathan B. L. (2003). The kidney : from normal development to congenital diseases. Amsterdam: Academic Press. ISBN 9780127224411. OCLC 162577398.
- ↑ Valdés-González, Rafael A; Dorantes, Luis M; Garibay, G Nayely; Bracho-Blanchet, Eduardo; Mendez, Armando J; Dávila-Pérez, Roberto; Elliott, Robert B; Terán, Luis; White, David J G (2005-9). Xenotransplantation of porcine neonatal islets of Langerhans and Sertoli cells: a 4-year study. European Journal of Endocrinology. Т. 153, № 3. с. 419—427. doi:10.1530/eje.1.01982. ISSN 0804-4643. Архів оригіналу за 18 листопада 2018. Процитовано 19 травня 2019.
- ↑ Korbutt, G. S.; Elliott, J. F.; Rajotte, R. V. (1 лютого 1997). Cotransplantation of Allogeneic Islets With Allogeneic Testicular Cell Aggregates Allows Long-Term Graft Survival Without Systemic Immunosuppression. Diabetes (англ.). Т. 46, № 2. с. 317—322. doi:10.2337/diab.46.2.317. ISSN 0012-1797. Процитовано 19 травня 2019.
- ↑ Li, Yang; Xue, Wujun; Liu, Hongbao; Fan, Ping; Wang, Xiaohong; Ding, Xiaoming; Tian, Xiaohui; Feng, Xinshun; Pan, Xiaoming (20 лютого 2013). Kerkis, Irina (ред.). Combined Strategy of Endothelial Cells Coating, Sertoli Cells Coculture and Infusion Improves Vascularization and Rejection Protection of Islet Graft. PLoS ONE (англ.). Т. 8, № 2. с. e56696. doi:10.1371/journal.pone.0056696. ISSN 1932-6203. PMC 3577699. PMID 23437215. Процитовано 19 травня 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Luca, Giovanni; Arato, Iva; Mancuso, Francesca; Calvitti, Mario; Falabella, Giulia; Murdolo, Giuseppe; Basta, Giuseppe; Cameron, Don F.; Hansen, Barbara C. (11 2016). Xenograft of microencapsulated Sertoli cells restores glucose homeostasis in db/db mice with spontaneous diabetes mellitus. Xenotransplantation. Т. 23, № 6. с. 429—439. doi:10.1111/xen.12274. ISSN 1399-3089. PMID 27678013. Архів оригіналу за 23 липня 2018. Процитовано 19 травня 2019.
- ↑ Bistoni, Giovanni; Calvitti, Mario; Mancuso, Francesca; Arato, Iva; Falabella, Giulia; Cucchia, Rosa; Fallarino, Francesca; Becchetti, Alessio; Baroni, Tiziano (2012-7). Prolongation of skin allograft survival in rats by the transplantation of microencapsulated xenogeneic neonatal porcine Sertoli cells. Biomaterials (англ.). Т. 33, № 21. с. 5333—5340. doi:10.1016/j.biomaterials.2012.04.020. Архів оригіналу за 16 червня 2022. Процитовано 19 травня 2019.
- ↑ Hemendinger, Richelle; Wang, Jay; Malik, Saafan; Persinski, Rafal; Copeland, Jane; Emerich, Dwaine; Gores, Paul; Halberstadt, Craig; Rosenfeld, Jeffrey (2005-12). Sertoli cells improve survival of motor neurons in SOD1 transgenic mice, a model of amyotrophic lateral sclerosis. Experimental Neurology. Т. 196, № 2. с. 235—243. doi:10.1016/j.expneurol.2005.07.025. ISSN 0014-4886. PMID 16242126. Процитовано 19 травня 2019.
- ↑ Schulz, Rüdiger W.; de França, Luiz Renato; Lareyre, Jean-Jacques; LeGac, Florence; Chiarini-Garcia, Helio; Nobrega, Rafael Henrique; Miura, Takeshi (2010-2). Spermatogenesis in fish. General and Comparative Endocrinology (англ.). Т. 165, № 3. с. 390—411. doi:10.1016/j.ygcen.2009.02.013. Архів оригіналу за 22 серпня 2018. Процитовано 19 травня 2019.
- ↑ Morais, R. D. V. S.; Nóbrega, R. H.; Gómez-González, N. E.; Schmidt, R.; Bogerd, J.; França, L. R.; Schulz, R. W. (2013-11). Thyroid Hormone Stimulates the Proliferation of Sertoli Cells and Single Type A Spermatogonia in Adult Zebrafish ( Danio rerio ) Testis. Endocrinology (англ.). Т. 154, № 11. с. 4365—4376. doi:10.1210/en.2013-1308. ISSN 0013-7227. Процитовано 19 травня 2019.
- ↑ Lacerda, S. M. S. N.; Costa, G. M. J.; Campos-Junior, P. H. A.; Segatelli, T. M.; Yazawa, R.; Takeuchi, Y.; Morita, T.; Yoshizaki, G.; França, L. R. (2013-2). Germ cell transplantation as a potential biotechnological approach to fish reproduction. Fish Physiology and Biochemistry. Т. 39, № 1. с. 3—11. doi:10.1007/s10695-012-9606-4. ISSN 1573-5168. PMID 22290474. Архів оригіналу за 16 травня 2020. Процитовано 19 травня 2019.
- ↑ Almeida, Fernanda F. L.; Kristoffersen, Cathrine; Taranger, Geir Lasse; Schulz, Rüdiger W. (2008-1). Spermatogenesis in Atlantic cod (Gadus morhua): a novel model of cystic germ cell development. Biology of Reproduction. Т. 78, № 1. с. 27—34. doi:10.1095/biolreprod.107.063669. ISSN 0006-3363. PMID 17881768. Процитовано 19 травня 2019.
| Це незавершена стаття з клітинної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |
