Користувачка:Катерина997721/Чернетка
Лейкоци́ти (грец. leuko — білий, kytos — тільце) — неоднорідна група безбарвних клітин крові, що складаються із цитоплазми та ядра і утворюються в червоному кістковому мозку.[1][2] На відміну від інших клітин крові, лейкоцити мають ядро, здатні до активного амебоїдного руху за допомогою псевдоподій,[3] позитивного хемотаксису (до патогенних організмів, їх токсинів, комплексів антиген-антитіло, фрагментів клітин власного організму), фагоцитозу,[4] адгезії та діапедезу.[5]
Лейкоцити в організмі виконують такі функції:
- Захисна — основна функція лейкоцитів,[3] полягає у знешкодженні лейкоцитами патогенів шляхом фагоцитозу, продукції антитіл,[4] нетозу (нетоз — особлива форма клітинної загибелі, що властива нейтрофілам).[6] Лейкоцити розпізнають ендотелій судин у різних тканинах,[5] завдяки здатності до амебоїдного руху вони можуть проникати крізь стінки капілярів (діапедез) і виходити у міжклітинний простір, рухаючись до ураження.[4] При потраплянні у тканину патогену, з ним спочатку взаємодіють місцеві лейкоцити тканин (дендритні клітини, тканинні макрофаги (гістіоцити), базофіли, мастоцити, деякі популяції лімфоцитів), ініціюючи імунну відповідь та розвиток запалення.[5]
- Видільна — полягає у захопленні лейкоцитами дрібних часточок пилу у легенях, мікроушкодженнях шкіри тощо, і транспортуванні цих часточок до кишечнику (якщо лейкоцит не здатний їх перетравити), звідки вони виводяться за межі організму.[4]
- Поживна — виражена у амебоцитів кишковопорожнинних і лейкоцитів мальків риб. Полягає у перетравленні захоплених часточок з виділенням поживних речовин, які можуть використати інші клітини тіла.[4]
Діаметр лейкоцитів коливається від 5 до 30 мікрометрів. Тривалість життя лейкоцитів теж варіює в широких межах (від 6-10 годин до кількох років або навіть усього життя людини).[4] Кількість лейкоцитів на один мікролітр крові у людини варіює від 4 до 10 тисяч, що приблизно в тисячу разів менше від кількості еритроцитів, але лише невелика частина лейкоцитів (не більш як 20 %) знаходиться у крові та лімфі, тоді як більшість з (приблизно половина) перебуває у тканинах, і ще третина — в кістковому мозку та лімфоїдних органах.[4][5] Немовлята можуть мати значно вищу кількість лейкоцитів на один мікролітр крові, так у немовлят може бути від 9 до 30 тисяч лейкоцитів у мікролітрі, а у дітей до двох років — від 6,2 до 17 тисяч.[7] Оскільки після утворення в червоному кістковому мозку лейкоцити циркулюють у крові від 4 до 72 годин[3] (для порівняння, еритроцити перебувають у крові близько 120 діб, а тромбоцити — 10 діб),[5] поки не потраплять до периферичних тканин або спеціалізованих лімфоїдних органів, в яких вони виконуватимуть свої функції,[3][5] вважається, що перебування лейкоцитів у крові є тимчасовим.[4][3]

Морфологічно лейкоцити ділять на зернисті (гранулоцити) та незернисті (агранулоцити). За здатністю до забарвлення кислими, нейтральними та основними барвниками, гранулоцити поділяються на еозинофіли, нейтрофіли та базофіли відповідно. Агранулоцити поділяють на лімфоцити та моноцити.[3][4] В багатьох випадках лейкоцити можна розрізнити за допомомогою оптичного мікроскопу морфологічно за формою і розміром ядра, виглядом і кількістю цитоплазматичних включень і гранул, ядерно-цитоплазматичним співвідношенням, наявністю цитоплазматичних виростів.[5] Але в деяких випадках розрізнити складно навіть за допомогою електронного мікроскопа (наприклад деякі субпопуляції лімфоцитів), в таких випадках використовують імунофенотипування.[5]
Кожен тип лейкоцитів виконує свої спеціалізовані функції, так гранулоцити та активовані моноцити є основою неспецифічного імунітету, тоді як лімфоцити є основою специфічного імунітету. Імунна відповідь можлива завдяки взаємодії специфічного та неспецифічного імунітету.[5]
| Тип | Ілюстрація | Частка
у крові дорослих |
Діаметр
(мкм)[8] |
Ядро[8] | Гранули[8] | Тривалість
життя[8] | |
|---|---|---|---|---|---|---|---|
| Гранулоцити | Нейтрофіли | 
|
62% | 10—12 | Сегментоване | Дрібні, рожеві | Від 6 годин
до кількох днів |
| Еозинофіли | 
|
2,3% | 10—12 | Двосегментне | Рожево-
оранжеві |
8—12 днів
у тканиніах, циркулюють 4—5 годин | |
| Базофіли | 
|
0,4% | 12—15 | Дво- або
трисегментне |
Великі, сині | Від кількох
годин до кількох діб | |
| Агранулоцити | Лімфоцити | 
|
30% | Малі:
7—8 Великі: 12—15 |
Велике,
кругле, ексцентиче, глибоко забарвлене |
Є у NK-клітин
та у (CD8+) цитотоксичних Т-клітин |
Тижні для
більшості, роки для клітин мам'яті |
| Моноцити | 
|
5,3% | 15—30[9] | Бобоподібне | Немає | Від кількох
годин до кількох днів | |
Кількість гранулоцитів становить близько 50—70% від усіх лейкоцитів в крові.[4][5] Гранулоцити мають поліморфні ядра,[10] а у своїй цитоплазмі містять гранули, і в залежності від того якими барвниками вони забарвлюються (кислими, нейтральними чи основними), їх поділяють на еозинофільні, нейтрофільні та базофільні гранулоцити. Гранулоцити розвиваються у червоному кістковому мозку близько 15 діб і далі, вже зрілими і готовими до зустрічі з антигеном, надходять у кров. Зрілі гранулоцити вже не здатні до поділу, а тривалість їхнього життя в тканинах становить кілька діб. Гранулоцити є складовою неспецифічного імунітету, і вони захищають організм від патогенних мікроорганізмів та позаклітинних організмів завдяки їхній здатності до фагоцитозу, екзоцитозу вмісту власних гранул, індукції запалення,[5] та нетозу.[6]

Нейтрофіли є найбільшою за чисельністю популяцією лейкоцитів: вони становлять 40—60% від усіх лейкоцитів[3] і 93—96% від усіх гранулоцитів,[5] при цьому лише 10% з них перебувають у крові.[4] Діаметр нейтрофілів становить близько 10—20 мкм,[3] тому І.І. Мечников назвав їх мікрофагами.[5]
Утворення нейтрофілів відбувається у кістковому мозку, де вони перебувають близько 5—7 днів після дозрівання, вони виходять у кров, де вони утворюють пул циркулюючих нейтрофілів і пул пристінкових.[3] У крові вони перебувають від 7 до 8 годин, поки не дістануться до тканин, зокрема слизових оболонок та запалення.[4] Нейтрофіли визначають місце для виходу в тканини завдяки адгезивним молекулам (Р-селектин), які експресуються ендотеліоцитами судин під дією медіаторів запалення.[5]

Зрілі нейтрофіли — сегментоядерні клітини (їх ядро складається з 3—5 часточок, які з'єднані тонкими перемичками)[11], сегментоване ядро допомагає їм витягуватися, рухаючись між клітинами в зоні запалення, і не дає нейтрофілам ділитися. Сегментація ядра зростає по мірі дозрівання нейтрофіла, тому на різних стадіях нейтрофіли за формою ядра називають юними (мають бобоподібне ядро), паличкоядерними (мають S-подібне ядро), та сегментоядерними.[3][5] Завдяки своїм сегментованим ядрам, нейтрофіли отримали назву
поліморфноядерні лейкоцити.[5]
Нейтрофіли здатні виконувати свої функції у анаеробних умовах завдяки гліколізу.[5]

В своїй цитоплазмі нейтрофіли містять три типи гранул:
- Первинні (азурофільні) — містять мієлопероксидазу (завдяки наявності гему, зумовлює зеленувате забарвлення нейтрофілів), лізоцим (гідролізує глікопротеїни оболонок бактерій) та катіонні білки.
- Вторинні — містять лактоферин (протеїн, який зв’язує різні антимікробні речовини, що пошкоджують мембрани бактерій, зокрема ціанкобаламін та лізоцим).
- Третинні — лізосоми, які містять кислі гідролази, якими перетравлюють фагоцитовані патогени.[5][3] Не можуть поновлюватися, тому нейтрофіли гинуть після фагоцитозу кількох патогенів.[12]
Нейтрофіли проникають до місця ураження першими, тому їх також називають клітинами гострої фази запалення. Вони досягають його завдяки здатності до хемотаксису. Хемотаксичну активність щодо нейтрофілів мають: білки бактерій, які мають формілметіонін на своєму N-кінці, лейкотрієни, С3a та С5а (продукти активації комплементу), інтерлейкін-8, фактори запалення, що виділяються базофілами, лімфоцитами і мастоцитами. На своїй поверхні нейтрофіли мають лектинові рецептори, для взаємодії з клітинними стінками бактерій, та рецептори до опсонінів (Fc-фрагменти антитіл, білки гострої фази, С3b компонент системи комплементу), тому нейтрофілам легше фагоцитувати опсонізовані комплементом та антитілами мікроорганізми. Також при зв'язуванні з антигенами, антимікробні речовини, що містяться в гранулах нейтрофілів, можуть звільнятися та знешкоджувати широкий спектр патогенних організмів у процесі, що називається дегрануляція. Також ці антимікробні речовини можуть ушкоджувати оточуючі тканини і призводити до формування абсцесу (наповнена гноєм порожнина в м'яких тканинах). У гної міститься велика кількість нейтрофілів, тому гній має зеленувате забарвлення.[3][5][13][14] Також нейтрофіли на своїй поверхні переносять абсорбовані антитіла та деякі інші білки до місця запалення.[4]

Особливим способом нейтралізації мікробів, до якого можуть вдаватися нейтрофіли, є нетоз — особлива регульована форма загибелі відкрита 2004 року, в результаті якої нейтрофіл разом з антибактеріальними білками вивільняє свій власний хроматин, утворюючи нейтрофільні позаклітинні пастки, які захоплюють та вбивають патогени. Для активації нетозу важливими є мієлопероксидаза, нейтрофільна еластаза та НАДФН. Нейтрофільні позаклітинні пастки стабілізуються білками, і білки зумовлюють їх антибактеріальні властивості, наприклад, хлорна кислота, що виділяється внаслідок активності мієлопероксидази. Нейтрофільні позаклітинні пастки також можуть взаємодіяти з системами комплементу та коагуляції. Є дослідження, що вказують на взаємозв'язок між нетозом і аутоімунними захворювання, зокрема цукровий діабет, атеросклероз та васкуліт.[14]
При збільшенні потреби в нейтрофілах (наприклад під час запалення), вони активніше виходять з кісткового мозку у кров. Збільшення надходження нейтрофілів може відбутися внаслідок реакції перерозподілу або за рахунок посилення інтенсивності лейкопоезу.
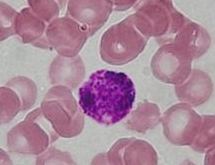
Базофільні гранулоцити — лейкоцити з дво- або трилопатевим ядром,[15] великі гранули яких забарвлюються основними барвниками у синій колір і містять анафілатоксичні речовини, такі як анафілатоксин, гістамін, гепарин, хондроїтинсульфат та інші медіатори запалення. Чисельність базофілів становить лише 0,5—1% від усіх лейкоцитів крові, а діаметр близко 10—12 мкм. На поверхні базофілів містяться рецептори до Fс-фрагментів ІgЕ та С3a- і С5а-компонентів системи комплементу. Зв'язування цих речовин з рецепторами призводить до дегрануляції базофілів. Вивільнення анафілатоксичних речовин приводить до розширення судин та збільшення їх проникності (гістамін), і відповідно до набряку тканин, а також гепарин пригнічує зсідання крові. Це, зокрема, полегшує проникнення нейтрофілів до тканин. Базофіли також можуть виділяти хімічні сигнали, які залучають еозинофіли та нейтрофіли до місця ураження, також вони є джерелом серотоніну, брадикініну та деяких лізосомальних ферментів, крім того, гепарин активує ліполіз. В зону запалення базофіли прямують, головним чином, за рахунок таких хемокінів як ІЛ-8 та ССL2.[3][5][4][16]
Надмірна активація базофілів та мастоцитів може викликати реакцію гіперчутливості негайного типу,[5] зумовлюючи такі гострі та хронічні алергічні захворювання як анафілаксія, астма, атопічний дерматит та поліноз.[17]

Мастоцити (гладкі клітини) — гранулоцити, дуже подібні до базофілів за своїми функціями. Вони теж містять базофільні гранули з гістаміном, гепарином, хондроїтинсульфатом, вміст яких вивільняються у відповідь на ті ж стимули, що і гранулоцити базофілів.[5] Раніше їх навіть вважали базофілами, що вже "оселилися" в тканині, але це різні типи клітин.[18] На відміну від базофілів, мастоцити виходять в кров незрілими і дозрівають вже в тканинах, їх ядро кругле, вони досить великі і живуть значно довше від базофілів. Зрілі мастоцити перебувають у тканинах і не здатні рухатися до зони запалення, оскільки втрачають рецептори до більшості хемокінів, цитокінів та гемопоетичних факторів.[5][19] Також гранули мастоцитів не містять калікреїну, але містять триптазу, на відміну від гранул базофілів.[5]
Виділяють гладкі клітини слизових оболонок та гладкі клітини сполучних тканин. Вони відрізняються вмістом гранул (у гранулах мастоцитів слизових оболонок міститься менше гістаміну, оскільки вони містять триптазу, ці клітини називають мастоцитами Т, а гранули гладких клітин сполучних тканин містять, крім триптази, хімазу, катепсин С, карбоксипептидазу та інші нейтральні пептидази, тому ці клітини називають мастоцитами ТС), також вважається, що мастоцити слизових оболонок є Т-залежними, оскільки вони на своїй поверхні експресують МНС класу II.[5]
Мастоцити, як і базофіли, синтезують похідні арахідонової кислоти такі — простагландини, тромбоксани і лейкотрієни, конкретно гладкі клітини виділяють простагландин D2 і лейкотрієн С4. Ейкозаноїди, похідні арахідонової кислоти, відповідають за біль та відчуття жару у зоні запалення. Гладкі клітини виділяють речовини, що стимулюють диференціювання та активацію інших лейкоцитів. До цих речовин належать інтерлейкіни (IL1, IL4, IL5, IL6), що сприяють виникненню Т-хелперів типу II, та гемопоетин (гранулоцитарно-макрофагальний колонієстимулюючий фактор).[5]
Мастоцити присутні в більшості тканин, вони оточують кровоносні судини та нерви, знаходяться на межах між зовнішнім та внутрішнім середовищем (шкіра, слизові оболонки легенів, травного тракту та рота, кон’юнктива та ніс).[20]


Еозинофіли — гранулоцити з двосегментним ядром,[3] цитоплазма яких заповнена великими гранулами, які при фарбуванні еозином набувають рожево-оранжевого кольору,[8] а при фарбуванні за Романовського-Гімзою набувають червоного кольору.[21] Діаметр еозинофілів становить 10—12 мкм. Частка еозинофільних гранулоцитів у крові приблизно 2–4 % від усіх лейкоцитів та 4–7 % від гранулоцитів.[5]
У своїй цитоплазмі еозинофіли містять такі типи гранул:
- Незрілі специфічні (первинні) гранули — великі (> 0,5 мкм) сферичні гранули, що містять щільний аморфний матеріал, рідко зустрічаються у зрілих еозинофілах. Містять катіонні білки, різноманітні ферменти, попередники головного лужного білку (МВР – від англ. major basic protein).[22]
- Специфічні (вторинні) гранули — великі (> 0,5 мкм), здебільшого еліпсоїдні, зрілі гранули, в яких, на відмідміну від незрілих, у центрі міститься електронно-щільне ядро. У зрілих еозинофілах займають більшу частину цитоплазми. Містять катіонні білки та МВР,[22] які цитотоксичний вплив на гельмінти і зумовлюють забарвлення цих гранул кислими барвниками.[5] Також в них виявляють цитокіни, хемокіни, рецептори, ферменти та фактори росту.[22]
- Малі гранули (мікрогранули, EoSVs) — везикулотубулярні структури з діаметром від 150 до 300 нм. Формою вони бувають трубчасті, видовжені, вигнуті або круглі. Часто їх виявляють поблизу специфічних гранул, оскільки вони походять від них і доставляють вміст специфічних гранул для позаклітинного вивільнення. У мікрогранулах виявляють ферменти, MBP, IL-4 та IL-4Rα, CD63.[22]
Екзоцитоз є способом дегрануляції, який рідко спостерігаються у еозинофілів in vivo, але він може спостерігатися in vitro під час взаємодії еозинофілів з різними паразитичними гельмінтами та грибами, після стимуляції високою концентрацією фактора некрозу пухлини альфа (TNF-α ). Найчастіше in vivo дегрануляція еозинофілів відбувається у вигляді цитолізу та поступової дегрануляції, вони добре задокументовані при таких захворюваннях як: алергічний риніт, атопічний дерматит, астма, виразковий коліт, хвороба Крона, шигельоз, холера, карцинома шлунка та еозинофільний езофагіт.[22]
Еозинофіли виділяють (лейкотрієни, зокрема LTC4, LTD4, LTE4, простагландини, зокрема PGE2),[23] цитокіни (IL-1, IL-2, IL-4, IL-5, IL-6, IL-8, IL-13, та TNF альфа),[24][25] хемокіни, ферменти (еластаза, RNASE2 (рибонуклеаза, з антивірусною дією), пероксидаза еозинофілів), МВР (індукує дегрануляцію базофілів та мастоцитів і бере участь у ремоделюванні периферичних нервів),[26][27][28] катіонний білок (створює пори в мембранах клітин-мішеней, полегшуючи проникнення до клітин цитотоксичних молекул,[29] може інгібувати проліферацію Т-клітин, пригнічувати вироблення антитіл В-клітинами, викликати дегрануляцію мастоцитів та стимулювати секрецію глікозаміногліканів фібробластами),[30] фактори росту (TGF бета, VEGF, PDGF),[31][32][25] та активні форми кисню та реактивні сполуки азоту, які утворюються внаслідок дії пероксидази і викликають загибель клітинини-мішені.[33][25] Всі ці речовини залучені до запалення, алергій, аутоімунних реакцій та імунорегуляції,[22] але основний лужний білок, пероксидаза та катіонний білок є токсичними для багатьох тканин організму.[25] Еозинофіли викликають пошкодження тканин і запалення при багатьох захворюваннях, включно з астмою.[34][35]
Завдяки наявності великої кількості РНКаз у гранулах еозинофілів, вони відіграють певну роль у захисті організму від вірусних інфекцій. Також вони, разом з базофілами та гладкими клітинами, є важливими медіаторами алергічних реакцій, зокрема вони залучені до патогенезу астми. Крім того, еозинофіли захищають від гельмінтів і їх рівень може підвищуватисяпри гельмінтозах. Також еозинофіли беруть участь у розвитку молочної залози в постпубертатному періоді, естральному циклі, відторгненні алотрансплантата, розвитку неоплазіій, видаленні фібрину при запаленні,[25] презентації антигену Т-клітинам.[36]
Еозинофіли перебувають у кров'яному руслі близько 8—12 годин, вони рухаються до місця запалення під впливом хемотаксичних факторів.[3] Експресії молекул адгезії сприяє інтерлейкіну-5, а підвищений рівень інтерлейкіну-5 асоційований з запаленням і пошкодженням тканин.[35] У тканинах еозинофіли можуть перебувати до 12 днів.[8]
Агранулоцити — лейкоцити, що мають несегментоване ядро і не мають гранул у своїй цитоплазмі. Агранулоцити хребетних можна поділити на лімфоцити і моноцити. Лімфоцити складають основу гуморального імунітету, їх поділяють на В-лімфоцити (виробляють антитіла) і Т-лімфоцити (Т-кілери, Т-хелпери і Т-супресори) і NK-лімфоцити. Моноцити, або мононуклеарні фагоцити, у тканинах перетворюються в макрофаги, і вони беруть участь у клітинному імунітеті (знищують віруси і бактерії) і у гуморальному (сигналізують лімфоцитам про появу в організмі антигену).[37] На відміну від лімфоцитів, моноцити не мають власних специфічних до антигену рецепторів.[5]

Моноцити — великі (діамером від 16 до 20 мкм) лейкоцити, без цитоплазматичних гранул, з великим ядром, переважно бобоподібної форми, що складають від 4% до 8% від усіх лейкоцитів периферичної крові.[3][5] У крові моноцити перебувають від одного до трьох днів, приблизно половина від усіх моноцитів у дорослої людини зберігається у червоній пульпі селезінки.[38] Моноцити мають найвищу фагоцитарну активність серед усіх лейкоцитів.[4]
Моноцити називають також А-клітинами, бо вони здатні до адгезії на різноманітних субстратах, як на біологічних (колаген, фібрин, вітронектин) так і на небіологічних (скло, пластик). Незрілі моноцити є округлими, а після потрапляння до тканини вони набувають амебоїдної форми, утворюючи псевдоподії за рахунок вигинів плазмалеми,[5] а в їх цитоплазмі зростає кількість мітохондрій та лізосом.[4]

Залежно від поверхневих рецепторів, у крові людини виділяють три субпопуляції моноцитів:
- Класичні моноцити (CD14++ CD16− моноцити) експресують поверхневий антиген СD14 (рецептор до фактора, що зв'язує ліпополісахарид), що специфічним маркером моноцитарного ряду, і не експресують CD16 (рецептор до Fc-фрагментів IgG).
- Некласичні моноцити (CD14+ CD16++моноцити).
- Проміжні моноцити (CD14++CD16+ моноцити)[39][5][40][41]
Також моноцити на своїй поверхні мають ряд лектинових рецепторів для розпізнавання інших антигенів та рецептори до С3b-компонента комплементу. Важливою особливістю клітин моноцитарного ряду є здатність до процесингу та презентації фагоцитованих антигенів у комплексі з МНС II, далі ці антигени розпізнаються Т-клітинами. Також ці клітини можуть активуватися Т-лімфоцитами.[5]
Після потрапляння в тканини, моноцити перетворюються в макрофаги,[3] але іn vitro вони можуть диференціюватись в дендритні клітини, внаслідок додавання гранулоцитарно-макрофагального колонієстимулюючого фактору (GM-CSF) та інтерлейкіну 4.[42] Однак ці клітини зберігають транскриптом подібний до моноцитарного і скупчуються з моноцитами.[43] "Родинні" зв'язки між макрофагами й дендритними клітинами — дискусійне питання, але вони точно є результатом диференціювання спільних попередників моноцитарного ряду. Зрілі дендритні клітини втрачають СD14, який зберігається у макрофагів.[5]

Макрофаги фагоцитують патогени, ушкоджені клітини організму, апоптичні тільця та циркулюючі імунні комплекси, беруть участь у процесингу та презентації фагоцитованих антигенів у комплексі з МНС II та активації Т-хелперів, беруть участь у продукції деяких компонентів системи комплементу, ферментів, цитокінів, ендогенного пірогену (білок, що впливає на терморегуляторний центр гіпоталамуса і призводить до підвищення температури тіла), інтерферону. Також вони беруть участь у захисті від ракових клітин та відторгненні трансплантантів, регуляції гемопоезу.[3][5] Макрофаги також продукують активні форми кисню, зокрема оксид азоту, щоб вбивати фагоцитовані бактерії.[44]
Макрофаги та лімфоцити з'являються в зоні запалення на пізніх його етапах, тому вони належать до клітин хронічного запалення, а збільшення частки моноцитів у крові може свідчити про наявність хронічного запалення, тоді як нейтрофіли з'являються першими і належать до клітин гострого запалення. В зоні запалення макрофаги можуть зливатися з утворенням великих багатоядерних клітин.[5]
Макрофаги також впливають на розвиток запалення: макрофаги, що чинять прозапальну дію називаються макрофагами М1, а макрофаги, що чинять протизапальну дію та стимулюють відновлення тканин — макрофагами М2.[45] Макрофаги "вбивці" (макрофаги М1) виявляються на більш ранніх стадіях запалення, вони активуються ліпополісахаридом, інтерфероном гамма, фактором некрозу пухлин, DAMPs (damage associated molecular patterns). Макрофаги М1 секретують багато IL-12 та невелику кількість IL-10, також вони секретують IL-6 та фактор некрозу пухлин. Макрофаги M1 мають прозапальну, бактерицидну та фагоцитарну функції.[46] Макрофаги "відновлення" (макрофаги М2) залучені до загоєння ран та відновлення тканин, вони продукують протизапальні цитокіни, такі як IL-10 та TGF-бета у великій кількості, також вони продукують невелику кількість IL-12. Асоційовані з пухлиною макрофаги в основному мають фенотип М2 і, здається, активно сприяють росту пухлини.[47][46]
На своїй поверхні макрофаги містять велику кількість специфічних протеїнів, зокрема CD14, CD40, CD11b, CD64, F4/80 (у мишей)/EMR1 (у людей), лізоцим M, MAC-1/MAC-3 та CD68.[48] Вони експресують лектинового типу, якими вони розпізнають бактеріальні клітинні стінки та капсиди вірусів (наприклад манозні рецептори), Scavenger-рецептори та Тоll-lіке-рецептори, щоб розпізнавати продукти бактерій та інших мікроорганізмів. Тоll-lіке-рецептори специфічно зв'язуються з різними компонентами патогенних мікроорганізмів, такими як ліпополісахариди, РНК, ДНК, позаклітинні білки (наприклад флагелін). Також ними експресуються рецептори до компонентів комплементу (СR1 або СD35 до С3b компоненту, СR2 або СD21 до С3dg компоненту) та Fс-фрагментів антитіл (СD64 до FcγRI, СD32 до FcγRII, СD16 до FcγRIII). Крім того, на своїй поверхні макрофаги мають дуже пізній антиген (α4ß1-інтегрин), який зв'язується з VCAM-1, який експресується ендотеліоцитами через 6–10 год після дії медіаторів запалення (INFγ, ФНОα, ІЛ-4, ІЛ-1ß) і міститься на їх поверхні.VCAM-1.[5][44]
Залежно від органів в які потрапляють макрофаги, вони можуть мати різну морфологію, функції та назви.[5] Від 80 % до 90 % від усіх макрофагів — клітини Купфера.[49]
| Назва | Локалізація | Функції |
|---|---|---|
| Клітини Купфера | Печінкові
синусоїди[49] |
Захист від чужорідних частинок, що
потрапляють у портальну систему печінки, та власних зношених клітин, зокрема |
| Альвеолярні
фагоцити |
Альвеоли
легень[44] |
Фагоцитоз власних мертвих клітин, бактерій,
дрібних часточок. Захист дихальних шляхів.[44] |
| Остеокласти | Кістки (лакуни
Гаушіпа)[52] |
Перебудова кісткової тканини, резорбція |
| Макрофаги | Червона пульпа
і крайова зона селезінки[44] |
Фагоцитоз застарілих еритроцитів.[44] |
| Мікроглія | Центральна
нервова система |
Захист головного і спинного мозку.[44] |
| Макрофаги | Жирова тканина | Модуляція енергетичного обміну, пов'язані з
запаленням та метаболічними захворюваннями, що пов’язані з ожирінням.[53] |
| Клітини
Гофбауера |
Плацента | Перешкоджання вертикальній передачі
інфекцій, можливо участь у васкулогенезі та ангіогенезі в плаценті.[54] |
| Епітеліоїдні
клітини |
Гранульома | Незначна фагоцитарна активність, припускається
роль у розвитку фіброзу.[55] |

І макрофаги М1 і макрофаги М2 грають роль у розвитку атеросклерозу. Макрофаги М1 сприяють розвитку атеросклерозу через їх прозапальну дію, а макрофаги М2 при поглинанні великої кількості ліпопротеїнів низької щільності, що піддалися пероксидному окисненню, накопичують ліпіди і перетворюються на "пінні клітини", залишаючись між ендотелієм та м'язовою оболонкою судин. Коли такі клітини гинуть, їх рештки приваблюють інші макрофаги, що призводить до утворення "ліпідних бляшок".[5][56][57]
Дендритні клітини — професійні активатори Т-лімфоцитів. Головною їх функцією є презентація Т-клітинам антигенів, тому вони поєднують неспецифічний та специфічний імунітет. Ці клітини перебувають у тканинах, що контактують із зовнішнім середовищем, наприклад у шкірі (де вони називаються клітинами Лангерганса), слизових оболонках дихальних та травних шляхів. Після активації взаємодією з антигеном, вони мігрують до лімфатичних вузлів, де взаємодіють з В- та Т-лімфоцитами.[5][58] Вони також беруть участь у індукції та підтримці імунної толерантності в гомеостатичних умовах.
При дозріванні у дендритних клітинах збільшується продукція цитокінів, необхідних для активації наївних Т-клітин, підвищується експресія MHC-II та рецептора хемокінів CCR7.[59]
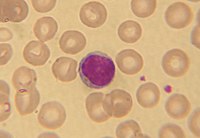

Лімфоцити — округлі агранулоцити, що мають велике ядро з конденсованим хроматином, що займає більшу частну клітини, і невелику кількість хроматину, що прилягає до ядра. Ці клітини зберегли здатність до проліферації і диференціювання, якщо на них подіє специфічний до них антиген, також вони здатні до рециркуляції між лімфоїдними органами, утворення клітин пам'яті. Лімфоцити становлять 25—40 % від усіх лейкоцитів в крові і 95 % клітин лімфи. Лімфоцити за розміром поділяють на малі, середні та великі. Діаметр малих лімфоцитів не перевищує 8 мкм, їх цитоплазма гомогенна, а ядро містить острівці конденсованого хроматину. Діаметр середніх лімфоцитів становить близько 8–12 мкм, цитоплазма і ядро у них подібні до малих лімфоцитів. Діаметр великих лімфоцитів складає від 12 до 14 мкм, вони мають велике світле ядро з ядерцем і зернами хроматину. Під час розвитку лімфоцита, він спочатку проводить стадію великого лімфоцита (лімфобласта), тоді як малі лімфоцити — це зрілі наївні лімфоцити.
Тривалість життя лімфоцитів досить велика, приблизно 80% з них живуть дуже довго (100– 200 діб). У грудній лімфатичній протоці таких лімфоцитів-довгожителів близько 90 %, у лімфатичних вузлах – 75 %, у селезінці – 25 %. Але після активації специфічним антигеном, 95 % лімфоцитів живуть 1—3 доби, за які встигають виконати свою функцію і загинути шляхом апоптозу, але 5 % з них перетворюються на клітини пам’яті, які можуть жити десятки років.
1969 року лімфоцити було поділено на Т- та В-клітини. Т-лімфоцити дозрівають у тимусі, а В-лімфоцити у ссавців дозрівають у кісткового мозку (Bone marrow), а у птахів — у бурсі Фабриціуса (Bursa Fabricia). Наївні Т- та В-лімфоцити дуже складно розрізнити морфологічно (під електронним мікроскопом видно, що у В-лімфоцитів краще розвинений ендоплазматичний ретикулюм), тому їх доцільніше розрізняти за поверхневими маркерами. Маркером Т-лімфоцитів є CD3, а В-лімфоцитів — CD19, CD20 та CD21. Але були виявлені клітини, що не містили на своїй поверхні цих маркерів, ці клітини були названі 0-клітинами), до них належать NK-клітини. Приблизно 70 % циркулюючих у крові лімфоцитів становлять Т-лімфоцити, 15 % — В-лімфоцити і 15 % — природні кіллери (NK-клітини). Т-лімфоцити та природні кіллери опосередковують клітинну ланку імунної відповіді, тоді як В-лімфоцити відповідальні за гуморальну ланку. Т- та В-клітини мають рецептори специфічні до певного антигену і відповідають за специфічний імунітет. Наївні лімфоцити зі сформованими рецепторами до певного антигену, чекають на взаємодію з ним у вторинних лімфоїдних органах. Після активації ним, вони проліферують.[5][3][4]

Природні кіллери (NK-клітини) — цитотоксичні лімфоцити, цитоплазма яких заповнена азурофільними гранулами, які містять перфорин і гранзими, якими вони спричиняють лізис клітин-мішеней або їх апоптоз, тому їх також називають великими гранулярними (зернистими) лімфоцитами.. Перфорини утворюють пори у мембрані уражених клітин, і крізь ці пори проникають гранзими, які викликають апоптоз або осмотичний лізис, а для вбивства бактерій природні кіллери мають α-дефензини, та антимікробні речовини.[60] Природні кіллери не мають специфічних до антигену рецепторів, на відміну від Т- та В-клітин, тобто вони здійснюють неспецифічний клітинний імунітет. Природні кіллери знищують уражені вірусами та трансформовані клітини.[5] Природніми кіллерами ці клітини називаються оскільки вони не потребують попередньої активації.[61] Для пошуку клітин-мішеней вони використовують два типи рецепторів: активаційний і гальмівний (КІR — killer inhibitory receptor). До активаційних рецепторів належать СD16, що забезпечує антитілозалежну клітинну цитотоксичність, оскільки вони містять на своїй поверхні СD16 (рецептор до Fс-фрагментів ІgG),[5] NCR (NKp46, NKp44 та NKp30), що є рецепторами до широкого спектру лігандів, які пов'язані з вірусними, бактеріальними та паразитарними інфекціями,[62] та Ly49 — лектинові рецептори, серед яких є і активаційні (Ly49D, Ly49H, Ly49L), які розпізнають, наприклад, специфічні вірусні протеїни, і гальмівні (Ly49A, B, C, E, G, Q).[63][64][65] Інгібуючий Lу49 та багато KIR взаємодіють з МНС I на поверхні власних клітин. Тому якщо на поверхні клітини недостатня кількість МНС I (це може бути обумовлене, наприклад, наявністю внутрішньоклітинного патогена), природній кіллер знищує її, а якщо МНС I достатньо, то він не реагує на неї. Це важливо, бо лише природні кіллери реагують на відсутність МНС I.[5][66] Також, активувати натуральні кіллери здатні деякі цитокіни, зокрема IL-12, IL-15, IL-18, IL-2, та CCL5. Для боротьби з вірусними інфекціями природні кіллери виділяють IFNγ і TNFα.[67] На своїй поверхні ці клітини містять маркери СD56, СD5, а 75 % з них містить рецептор СD2,[5] тоді як CD3 у них відсутній.[68]


В-Лімфоцити — лімфоцити, які експресують антигенспецифічні рецептори імуноглобулінової природи, також вони можуть презентувати антиген Т-лімфоцитам і секретувати цитокіни.[5][69] Зрілі і готові до взаємодії зі специфічним до них атигеном В-клітини, які ще його не зустріли, називають наївними В-лімфоцитами.[5][70] Активація антигеном наївних В-клітин здебільшого відбувається у вторинних лімфоїдних органах (селезінка, лімфатичні вузли).[69] Імуноглобуліни наївних В-лімфоцитів, як правило М або D класів, є мембраннозв'язаними. Імуноглобуліни класу М, що знаходяться на поверхні лімфоцита, розпізнають антиген, після чого він фагоцитується, процесується і презентується на МНС II, де їх розпізнають Т-хелпери.[5] При зв'язуванні з МНС II, Т-клітина експресує CD40L (поверхневий білок), який є лігандом CD40, що міститься на поверхні В-клітини, та цитокіни IL-4 і IL-2. Все це призводить до активації В-клітини.[69][71] Спочатку активований В-лімфоцит, що знаходиться поза лімфатичним вузликом (фолікулом),[72] проліферує, змінює клас імуноглобулінів та диференціюється на плазмобласт, що продукує переважно імуноглобуліни класу М.[73] Потім він проникає до лімфатичного вузлика, де і утворює гермінальний центр (центр розмноження), де починається інтенсивна проліферація, зміна класу імуноглобулінів,[74] і в результаті утворюються плазматичні клітини та В-клітини пам'яті.[72] Функцією плазматичних клітин є синтез антитіл, тому вони мають розвинений гранулярний ендоплазматичний ретикулум та апарат Гольджі, їх цитоплазма базофільна, внаслідок великої кількості мРНК в ній, і в його цитоплазмі помітні тільця Русселя (скупчення імуноглобулінів).[5]
Розрізняють два типи В-лімфоцитів: В1- і В2-клітини. В1 клітини, здебільшого, на своїй поверхні мають маркер СD5 (характерний для Т-лімфоцитів) та інтегрин Мас-1, але не мають СD23. Вони реагують на Т-незалежні антигени[5] (наприклад, полісахариди, нуклеотиди)[72] і, відповідно, не потребують взаємодії з Т-хелперами для активації, вони синтезують природні антитіла, що мають меншу афінність ніж антитіла В2 клітин. В1-лімфоцити продукують ІgМ, також вони не утворюють клітини пам'яті. Імовірно, В1-лімфоцити забезпечують неспецифічний гуморальний імунітет, і вони можуть бути попередниками В2 лімфоцитів.[5][69] В2-клітини забезпечують імунну відповідь на Т-залежні антигени і потребують Т-хелперів для активації, що описана вище.[75]


Т-лімфоцити — лімфоцити, характерною особливістю яких є здатність розпізнавати антиген тільки у формі антигенного пептиду, що перебуває в комплексі з антигенами гістосумісності МНС на антигенпрезентуючій клітині. Це розпізнавання здійснюється завдяки специфічному до певного лише одного антигену Т-клітинному рецептору (ТКР), що знаходиться на поверхні CD4+ клітин (Т-хелпери) та CD8+ клітин (цитотоксичні Т-клітини, Т-кіллери). Головним маркером Т-клітин є СD3 – мембранний комплекс, що бере участь у передачі сигналу від антигенспецифічного рецептора. Взаємодія з антигеном, разом з додатковими сигналами, активує Т-клітину. Зазвичай вона відбувається у вторинних лімфоїдних органах. CD4 та CD8 допомагають стабілізувати зв'язок між ТКР та МНС комплексом. У Т-хелперів далі молекула CD28, що знаходиться на їх поверхні, взаємодіє з CD80 (B7.1) або CD86 (B7.2) на поверхні антигенпрезентуючої клітини і запускає проліферацію Т-хелпера, в результаті якої утворюється величезна кількість специфічнихдо цього антигену Т-клітин. Але стимуляція CD28 також призводить до продукції CD152, який конкурує з CD28 за B7, пригнічуючи відповідь (негативний зворотній зв'язок). Т-кіллери більшою мірою покладаються на CD70 та CD137, ніж на CD28. Іншими важливими костимуляторними молекулами Т-клітин є ICOS, OX40 та 4-1BB, що взаємодіють зі звоїми лігандами на антигенпрезентуючій клітині. Подальша стимуляція цитокінами відіграє важливу роль у визначенні долі Т-клітини, наприклад, вплив IL-12 стимулює утворення Th1 (Т-хелпери 1), вплив IL-4 — Th2 (Т-хелпери 2), вплив IL-6 та IL-23 — Т-хелперів 17.[5][76]
За будовою Т-клітинного рецептора Т-клітини можна поділити на дві субпопуляції — Т-клітини з γδ-рецепторами (γδТ) та Т-клітини з αβ-рецепторами (αβТ). γδТ поширені у шкірі та слизових оболонках, мають СD3, але не проходять стадію дозрівання у тимусі. Імовірно, можуть розпізнавати нативні антигени, білки теплового шоку та ліпідні антигени.[5] αβТ розвиваються в тимусі і поділяються на Т хелпери (маркером є СD4) та цитотоксичні Т-клітини або Т-кіллери (маркером є СD4). Т-хелпери не знищують антиген безпосередньо, але активують ефекторні клітини: Т-хелпери 1 через антигенпрезентуючі клітини активують Т-кіллерів, а Т-хелпери 2 активують В-клітини. Т-кіллери, на відміну від Т-хелперів, є ефекторними клітинами. Завдяки здатності взаємодіяти з клітинами, шо несуть МНС 1,Т-кіллери можуть знищувати інфіковані, травмовані та злоякісно перероджені клітини.[5] Крім Т-клітин, що стимулюють клітинну відповідь, існують Т-клітини, що її пригнічують. Ці клітини називають супресорними або регуляторними. Вони запобігають аутоімунним реакціям, пригнічуючи активацію та проліферацію інших Т-клітин.[77] Т-супресори ще не достатньо вивчені, можуть експресувати як СD4, так і СD8.[5] Також були виявлені Т-клітини, які крім СD3 і αβ-ТКР, мають рецептори, які притаманні NK-клітинам. Ці клітини назвали натуральними Т-кіллерами. Імовірно, їх цитотоусичний вплив на клітини-мішені може бути як специфічним, так і неспецифічним.[5]
(Le) (4 — 9×109 од./л)
- Гранулоцити
- базофільні (0 — 1 %(0,5))
- еозинофільні (0 — 5 %)
- нейтрофільні
- сегментоядерні (49 — 75 %)
- паличкоядерні (0(1) — 6 %)
- метамієлоцити (0 — 1 %) (в СНД вик. «юні») <-мієлоцити<-промієлоцити<-мієлобласти
- Агранулоцити

Усі клітини крові у людини беруть початок у червоному кістковому мозку, який належить до первинних лімфоїдних органів, з плюрипотентних стовбурових кровотворних клітин (СКК), кількість яких становить 0,01–0,05 % від усіх клітин кісткового мозку. Поділ СКК може відбуватися як з диференціацією, так і без неї. В процесі диференціаціювання СКК обирають лімфоїдний (завершується утворенням лімфоцитів) або мієлоїдний шлях (завершується утворенням гранулоцитів, мегакаріоцитів, еритроцитів, моноцитів). Вихідні клітини-попередники називаються колонієутворювальними одиницями (КУО), попередниками мієлодного ряду є КУО-ГЕММ, які в подальшому дають початок КУО-МГ (попередник моноцитів і гранулоцитів), КУО-Т (попередники мегакаріоцитів), КУО-Е (попередники еритроцитів). КУО-ГМ дають початок уніпотентним КУО-Б (попередник базофілів), КУО-Ео (попередник еозинофілів), КУО-Гн (попередник нейтрофілів) і КУО-М (попередник моноцитів).
Утворення гранулоцитів називається гранулоцитопоезом, цей процес здіснюється за допомогою гранулоцитарно-макрофагального та гранулоцитарного колонієстимулювальних факторів. Першими морфологічно-розпізнаваними є мієлобласти (базофільні, еозинофільні та нейтрофільні) — великі клітини, з круглим ядром та великою кількістю рибосом. Вони дають початок промієлоцитам, які мають грубішу структуру ядра та специфічну зернистість. Після одного мітозу промієлоцити перетворюються на мієлоцити. Наступними є метамієлоцити. Ці клітини більше не діляться. Якщо вони потрапляють у периферичну кров, їх називають юними гранулоцитами. Наступною стадією є паличкоядерні гранулоцити, вони перетворюються на сегментоядерні гранулоцити, які є зрілою формою.
Утворення моноцитів називають моноцитопоезом. Першою морфологічно розпізнаваною клітиною цього ряду є моноцитобласт, який ділиться і перетворюється на промоноцит, а промоноцит, у свою чергу, — на моноцит. У ході цього процесу збільшується кількість цитоплазми, ядро стає бобоподібним, а цитоплазма стає менш базофільною. Важливу роль у цьому процесі відіграє макрофагальний колонієстимулювальний фактор. Кінцева стадія диференціації, макрофаг, утворюється у сполу. чній тканині.
Розвиток лімфоцитів називається лімфопоезом. СКК дає початок клітині-попереднику лімфопоезу. Далі виникають уніпотентні попередники Т- і В-лімфоцитів, потім лімфобласти, а потім лімфоцити. Розвиток Т-лімфоцитів проходить у тимусі. Подальше диференціювання є антигензалежним і проходить у вторинних лімфоїдних органах.[5][78]
Кількість лейкоцитів у крові має діагностичне значення і є частиною загального аналізу крові.[79] Збільшення кількості лейкоцитів понад норму називається лейкоцитозом, а зменшення — лейкопенією.
Лейкоцитоз буває фізіологічним (спостерігається у період перед менструацією, під час вагітності та пологів, після фізичного[2] та психоемоційного перенавантаження,[80] прийому гарячих і холодних ванн) та патологічним (виявляється при багатьох інфекційних закворюваннях[2] (переважно бактеріальних),[80] наприклад таких як пневмонія,[2] кашлюк,[81] менінгіт та сепсис, запальних процесах різної етіології, наприклад апендицит,[2] інтоксикаціях, алергіях тощо).[80] Патологічний лейкоцитоз може бути наслідком посиленого утворення лейкоцитів для боротьби з інфекцією, хвороби червоного кісткового мозку, що спричиняє посилене утворення лейкоцитів (гострий та хронічний лімфолейкоз, гострий та хронічний мієлолейкоз) певного розладу імунної системи (мієлофіброз), реакцією на лікарський препарат (кортикостероїди, адреналін), що збільшує вироблення лейкоцитів.[81] Ще однією причиною лейкоцитозу є паління.[81]
Лейкопенія виникає може бути наслідком гіпопластичних та апластичних процесів (апластична анемія), хвороб селезінки (гіперспленізм), опромінення, дії деяких медикаментів, зокрема сульфаніламідних препаратів, цитостатичних ліків, амідопірину, реопірину, бутадієну, та хімічних речовин, зокрема бензену та пестицидів; деяких інфекційних захворюваннь (переважно вірусних), які порушують роботу червоного кісткового мозку та важких інфекцій, при яких лейкоцити витрачаються швидше ніж утворюються (ВІЛ, малярія, грип, кір, краснуха, черевний тиф, бруцельоз, вірусний гепатит у гострій фазі); деяких вроджених розладів, що супроводжуються зниженням функцій кісткового мозку (мієлокатексис — вроджений розлад, при якому лейкоцити не можуть проникнути в кров, синдром Костмана — вроджений розлад, при якому утворення нейтрофілів є зниженим); аутоімунних розладів (системний червоний вовчак, ревматоїдний артрит), онкологічних та інші хвороб, що пошкоджують кістковий мозок (мієлодиспластичні синдроми, лейкози); гіпотрофії, авітамінозу (наприклад дефіцит фолієвої кислоти та кобаламіну) та зловживання алкоголем.[2][80][82][83] Також лейкопенія може спостерігатися при деяких ендокринних захворюваннях (хвороби щитоподібної залози та акромегалія)[2] та при анафілактичному шоці.[80]
- ↑ Human Biology and Health. Englewood Cliffs, New Jersey, US: Prentice Hall. 1997. ISBN 0-13-981176-1.
- ↑ а б в г д е ж ЛЕЙКОЦИТИ. Фармацевтична енциклопедія (укр.). Процитовано 3 січня 2021.
- ↑ а б в г д е ж и к л м н п р с т у ф х М.Р. Ґжеґоцький, В.І. Філімонов, Ю.С. Петришин, О.Г. Мисаковець (2005). Фізіологія людини. Київ: Книга плюс. с. 264—268. ISBN 966-7619-65-6.
- ↑ а б в г д е ж и к л м н п р с т у Чайченко Г. М., Цибенко В. О., Сокур В.Д. (2003). Фізіологія людини і тварин. Київ: Вища школа. с. 36—39. ISBN 966-642-013-9.
- ↑ а б в г д е ж и к л м н п р с т у ф х ц ш щ ю я аа аб ав аг ад ае аж аи ак ал ам ан ап ар ас ат ау аф ах ац аш ащ аю ая ба бб бв бг бд бе бж би бк Вершигора А.Ю., Пастер Є.У., Колибо Д.В., Віхоть М.Є., Моложава О.С. та ін. (2011). Імунологія. Київ: Київський університет. ISBN 978-966-439-349-9.
{{cite book}}: Явне використання «та ін.» у:|last=(довідка) - ↑ а б de Bont, Cynthia M.; Boelens, Wilbert C.; Pruijn, Ger J. M. (2019-01). NETosis, complement, and coagulation: a triangular relationship. Cellular & Molecular Immunology (англ.). Т. 16, № 1. с. 19—27. doi:10.1038/s41423-018-0024-0. ISSN 2042-0226. Процитовано 4 січня 2021.
- ↑ WBC (White Blood Cell) Count: Purpose, Procedure, and Results. Healthline (англ.). 25 липня 2012. Процитовано 5 січня 2021.
- ↑ а б в г д е Wheater, Paul R.; Daniels, Victor G., (1979). Functional histology : a text and colour atlas. Edinburgh: Churchill Livingstone. ISBN 0-443-01658-5. OCLC 5100989.
- ↑ Handin, Robert I.,; Lux, Samuel E.,; Stossel, Thomas P.,. Blood : principles and practice of hematology (вид. Second edition). Philadelphia, PA. ISBN 978-0-7817-1993-3. OCLC 49712243.
- ↑ Orkin, Stuart H.; Zon, Leonard I. (2008-02). SnapShot: Hematopoiesis. Cell (англ.). Т. 132, № 4. с. 712.e1—712.e2. doi:10.1016/j.cell.2008.02.013. Процитовано 6 січня 2021.
- ↑ Saladin, Kenneth S. (2012). Anatomy & physiology : the unity of form and function (вид. 6th ed). New York, NY: McGraw-Hill. ISBN 978-0-07-337825-1. OCLC 670324855.
- ↑ Stevens, Alan (Pathologist); Lowe, J. S. (James Steven); Young, Barbara (Pathologist) (2002). Wheater's basic histopathology : a colour atlas and text (вид. 4th ed.). Edinburgh: Churchill Livingstone. ISBN 978-0-443-07001-3. OCLC 50793098.
- ↑ Абсцес — ВУЕ. vue.gov.ua. Процитовано 7 січня 2021.
- ↑ а б de Bont, Cynthia M.; Boelens, Wilbert C.; Pruijn, Ger J. M. (23 березня 2018). NETosis, complement, and coagulation: a triangular relationship. Cellular & Molecular Immunology. Т. 16, № 1. с. 19—27. doi:10.1038/s41423-018-0024-0. ISSN 1672-7681. Процитовано 7 січня 2021.
- ↑ Falcone, Franco H.; Haas, Helmut; Gibbs, Bernhard F. (15 грудня 2000). The human basophil: a new appreciation of its role in immune responses. Blood (англ.). Т. 96, № 13. с. 4028—4038. doi:10.1182/blood.V96.13.4028. ISSN 1528-0020. Процитовано 7 січня 2021.
- ↑ Saladin, Kenneth S. (2012). Anatomy & physiology : the unity of form and function (вид. 6th ed). New York, NY: McGraw-Hill. ISBN 978-0-07-337825-1. OCLC 670324855.
- ↑ Mukai, K; Galli, Sj (13 червня 2013). John Wiley & Sons, Ltd (ред.). Basophils. eLS (англ.). Chichester, UK: John Wiley & Sons, Ltd. с. a0001120.pub3. doi:10.1002/9780470015902.a0001120.pub3. ISBN 978-0-470-01617-6.
- ↑ Franco, Christopher B.; Chen, Ching-Cheng; Drukker, Micha; Weissman, Irving L.; Galli, Stephen J. (2 квітня 2010). Distinguishing mast cell and granulocyte differentiation at the single-cell level. Cell Stem Cell. Т. 6, № 4. с. 361—368. doi:10.1016/j.stem.2010.02.013. ISSN 1875-9777. PMC 2852254. PMID 20362540. Процитовано 8 січня 2021.
- ↑ Marieb, Elaine Nicpon, 1936- (2004). Human anatomy & physiology (вид. 6th ed). New York: Pearson Education. ISBN 0-8053-5463-8. OCLC 51817511.
- ↑ Prussin, Calman; Metcalfe, Dean D. (2003-02). 4. IgE, mast cells, basophils, and eosinophils. The Journal of Allergy and Clinical Immunology. Т. 111, № 2 Suppl. с. S486—494. doi:10.1067/mai.2003.120. ISSN 0091-6749. PMID 12592295. Процитовано 9 січня 2021.
- ↑ Rosenberg, Helene F.; Phipps, Simon; Foster, Paul S. (2007-06). Eosinophil trafficking in allergy and asthma. The Journal of Allergy and Clinical Immunology. Т. 119, № 6. с. 1303—1310, quiz 1311–1312. doi:10.1016/j.jaci.2007.03.048. ISSN 0091-6749. PMID 17481712. Процитовано 11 січня 2021.
- ↑ а б в г д е Melo, Rossana C. N.; Weller, Peter F. (2018-7). Contemporary understanding of the secretory granules in human eosinophils. Journal of leukocyte biology. Т. 104, № 1. с. 85—93. doi:10.1002/JLB.3MR1217-476R. ISSN 0741-5400. PMC 6013358. PMID 29749658. Процитовано 10 січня 2021.
- ↑ Bandeira-Melo, Christianne; Bozza, Patricia T.; Weller, Peter F. (2002-03). The cellular biology of eosinophil eicosanoid formation and function. The Journal of Allergy and Clinical Immunology. Т. 109, № 3. с. 393—400. doi:10.1067/mai.2002.121529. ISSN 0091-6749. PMID 11897981. Процитовано 11 січня 2021.
- ↑ Hogan, Simon P.; Rosenberg, Helene F.; Moqbel, Redwan; Phipps, Simon; Foster, Paul S.; Lacy, Paige; Kay, A. Barry; Rothenberg, Marc E. (2008-05). Eosinophils: biological properties and role in health and disease. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. Т. 38, № 5. с. 709—750. doi:10.1111/j.1365-2222.2008.02958.x. ISSN 1365-2222. PMID 18384431. Процитовано 11 січня 2021.
- ↑ а б в г д Rothenberg, Marc E.; Hogan, Simon P. (2006). The eosinophil. Annual Review of Immunology. Т. 24. с. 147—174. doi:10.1146/annurev.immunol.24.021605.090720. ISSN 0732-0582. PMID 16551246. Процитовано 11 січня 2021.
- ↑ Zheutlin, L. M.; Ackerman, S. J.; Gleich, G. J.; Thomas, L. L. (1984-10). Stimulation of basophil and rat mast cell histamine release by eosinophil granule-derived cationic proteins. Journal of Immunology (Baltimore, Md.: 1950). Т. 133, № 4. с. 2180—2185. ISSN 0022-1767. PMID 6206154. Процитовано 11 січня 2021.
- ↑ Morgan, Ross K.; Costello, Richard W.; Durcan, Niamh; Kingham, Paul J.; Gleich, Gerald J.; McLean, W. Graham; Walsh, Marie-Therese (2005-08). Diverse effects of eosinophil cationic granule proteins on IMR-32 nerve cell signaling and survival. American Journal of Respiratory Cell and Molecular Biology. Т. 33, № 2. с. 169—177. doi:10.1165/rcmb.2005-0056OC. ISSN 1044-1549. PMID 15860794. Процитовано 11 січня 2021.
- ↑ Slifman, N. R.; Loegering, D. A.; McKean, D. J.; Gleich, G. J. (1 листопада 1986). Ribonuclease activity associated with human eosinophil-derived neurotoxin and eosinophil cationic protein. Journal of Immunology (Baltimore, Md.: 1950). Т. 137, № 9. с. 2913—2917. ISSN 0022-1767. PMID 3760576. Процитовано 11 січня 2021.
- ↑ Young, J. D.; Peterson, C. G.; Venge, P.; Cohn, Z. A. (1986 Jun 5-11). Mechanism of membrane damage mediated by human eosinophil cationic protein. Nature. Т. 321, № 6070. с. 613—616. doi:10.1038/321613a0. ISSN 0028-0836. PMID 2423882. Процитовано 11 січня 2021.
- ↑ Venge, P.; Byström, J.; Carlson, M.; Hâkansson, L.; Karawacjzyk, M.; Peterson, C.; Sevéus, L.; Trulson, A. (1999-09). Eosinophil cationic protein (ECP): molecular and biological properties and the use of ECP as a marker of eosinophil activation in disease. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. Т. 29, № 9. с. 1172—1186. doi:10.1046/j.1365-2222.1999.00542.x. ISSN 0954-7894. PMID 10469025. Процитовано 11 січня 2021.
- ↑ Kato, Yoshiko; Fujisawa, Takao; Nishimori, Hisashi; Katsumata, Hajime; Atsuta, Jun; Iguchi, Kosei; Kamiya, Hitoshi (2005). Leukotriene D4 induces production of transforming growth factor-beta1 by eosinophils. International Archives of Allergy and Immunology. Т. 137 Suppl 1. с. 17—20. doi:10.1159/000085427. ISSN 1018-2438. PMID 15947480. Процитовано 11 січня 2021.
- ↑ Horiuchi, T.; Weller, P. F. (1997-07). Expression of vascular endothelial growth factor by human eosinophils: upregulation by granulocyte macrophage colony-stimulating factor and interleukin-5. American Journal of Respiratory Cell and Molecular Biology. Т. 17, № 1. с. 70—77. doi:10.1165/ajrcmb.17.1.2796. ISSN 1044-1549. PMID 9224211. Процитовано 11 січня 2021.
- ↑ Saito, Keiko; Nagata, Makoto; Kikuchi, Izumi; Sakamoto, Yoshio (2004-12). Leukotriene D4 and eosinophil transendothelial migration, superoxide generation, and degranulation via beta2 integrin. Annals of Allergy, Asthma & Immunology: Official Publication of the American College of Allergy, Asthma, & Immunology. Т. 93, № 6. с. 594—600. doi:10.1016/S1081-1206(10)61269-0. ISSN 1081-1206. PMID 15609771. Процитовано 11 січня 2021.
- ↑ Lambrecht, Bart N.; Hammad, Hamida (2015-01). The immunology of asthma. Nature Immunology. Т. 16, № 1. с. 45—56. doi:10.1038/ni.3049. ISSN 1529-2916. PMID 25521684. Процитовано 11 січня 2021.
- ↑ а б Sanderson, C. J. (15 червня 1992). Interleukin-5, eosinophils, and disease. Blood. Т. 79, № 12. с. 3101—3109. ISSN 0006-4971. PMID 1596561. Процитовано 11 січня 2021.
- ↑ Shi, Huan-Zhong (2004-09). Eosinophils function as antigen-presenting cells. Journal of Leukocyte Biology. Т. 76, № 3. с. 520—527. doi:10.1189/jlb.0404228. ISSN 0741-5400. PMID 15218055. Процитовано 11 січня 2021.
- ↑ Агранулоцити — ВУЕ. vue.gov.ua (укр.). Процитовано 12 січня 2021.
- ↑ Swirski, Filip K.; Nahrendorf, Matthias; Etzrodt, Martin; Wildgruber, Moritz; Cortez-Retamozo, Virna; Panizzi, Peter; Figueiredo, Jose-Luiz; Kohler, Rainer H.; Chudnovskiy, Aleksey (31 липня 2009). Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science (New York, N.Y.). Т. 325, № 5940. с. 612—616. doi:10.1126/science.1175202. ISSN 1095-9203. PMC 2803111. PMID 19644120. Процитовано 17 січня 2021.
- ↑ Ziegler-Heitbrock, Loems; Ancuta, Petronela; Crowe, Suzanne; Dalod, Marc; Grau, Veronika; Hart, Derek N.; Leenen, Pieter J. M.; Liu, Yong-Jun; MacPherson, Gordon (21 жовтня 2010). Nomenclature of monocytes and dendritic cells in blood. Blood. Т. 116, № 16. с. e74—80. doi:10.1182/blood-2010-02-258558. ISSN 1528-0020. PMID 20628149. Процитовано 17 січня 2021.
- ↑ Yeap, Wei Hseun; Wong, Kok Loon; Shimasaki, Noriko; Teo, Esmeralda Chi Yuan; Quek, Jeffrey Kim Siang; Yong, Hao Xiang; Diong, Colin Phipps; Bertoletti, Antonio; Linn, Yeh Ching (27 вересня 2016). CD16 is indispensable for antibody-dependent cellular cytotoxicity by human monocytes. Scientific Reports. Т. 6. с. 34310. doi:10.1038/srep34310. ISSN 2045-2322. PMC 5037471. PMID 27670158. Процитовано 17 січня 2021.
- ↑ Ziegler-Heitbrock, Loems (2007-03). The CD14+ CD16+ blood monocytes: their role in infection and inflammation. Journal of Leukocyte Biology. Т. 81, № 3. с. 584—592. doi:10.1189/jlb.0806510. ISSN 0741-5400. PMID 17135573. Процитовано 17 січня 2021.
- ↑ Sallusto, F.; Cella, M.; Danieli, C.; Lanzavecchia, A. (1 серпня 1995). Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products. The Journal of Experimental Medicine. Т. 182, № 2. с. 389—400. doi:10.1084/jem.182.2.389. ISSN 0022-1007. PMC 2192110. PMID 7629501. Процитовано 18 січня 2021.
- ↑ Robbins, Scott H.; Walzer, Thierry; Dembélé, Doulaye; Thibault, Christelle; Defays, Axel; Bessou, Gilles; Xu, Huichun; Vivier, Eric; Sellars, Maclean (24 січня 2008). Novel insights into the relationships between dendritic cell subsets in human and mouse revealed by genome-wide expression profiling. Genome Biology. Т. 9, № 1. с. R17. doi:10.1186/gb-2008-9-1-r17. ISSN 1474-760X. PMC 2395256. PMID 18218067. Процитовано 18 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г д е ж Macrophages | British Society for Immunology. www.immunology.org. Процитовано 19 січня 2021.
- ↑ Mills, Charles D. (2012). M1 and M2 Macrophages: Oracles of Health and Disease. Critical Reviews in Immunology. Т. 32, № 6. с. 463—488. doi:10.1615/critrevimmunol.v32.i6.10. ISSN 1040-8401. PMID 23428224. Процитовано 18 січня 2021.
- ↑ а б Hesketh, Mark; Sahin, Katherine B.; West, Zoe E.; Murray, Rachael Z. (17 липня 2017). Macrophage Phenotypes Regulate Scar Formation and Chronic Wound Healing. International Journal of Molecular Sciences. Т. 18, № 7. doi:10.3390/ijms18071545. ISSN 1422-0067. PMC 5536033. PMID 28714933. Процитовано 18 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Galdiero, Maria R.; Garlanda, Cecilia; Jaillon, Sébastien; Marone, Gianni; Mantovani, Alberto (2013-07). Tumor associated macrophages and neutrophils in tumor progression. Journal of Cellular Physiology. Т. 228, № 7. с. 1404—1412. doi:10.1002/jcp.24260. ISSN 1097-4652. PMID 23065796. Процитовано 18 січня 2021.
- ↑ Khazen, Wael; M'bika, Jean-Pierre; Tomkiewicz, Céline; Benelli, Chantal; Chany, Charles; Achour, Ammar; Forest, Claude (24 жовтня 2005). Expression of macrophage-selective markers in human and rodent adipocytes. FEBS letters. Т. 579, № 25. с. 5631—5634. doi:10.1016/j.febslet.2005.09.032. ISSN 0014-5793. PMID 16213494. Процитовано 18 січня 2021.
- ↑ а б в Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020). Histology, Kupffer Cell. StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 29630278.
- ↑ Helmy, Karim Y.; Katschke, Kenneth J.; Gorgani, Nick N.; Kljavin, Noelyn M.; Elliott, J. Michael; Diehl, Lauri; Scales, Suzie J.; Ghilardi, Nico; van Lookeren Campagne, Menno (10 березня 2006). CRIg: a macrophage complement receptor required for phagocytosis of circulating pathogens. Cell. Т. 124, № 5. с. 915—927. doi:10.1016/j.cell.2005.12.039. ISSN 0092-8674. PMID 16530040. Процитовано 19 січня 2021.
- ↑ Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020). Histology, Kupffer Cell. StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 29630278.
- ↑ а б Osteoclast | cell. Encyclopedia Britannica (англ.). Процитовано 19 січня 2021.
- ↑ Li, Yunjia; Yun, Ke; Mu, Runqing (9 липня 2020). A review on the biology and properties of adipose tissue macrophages involved in adipose tissue physiological and pathophysiological processes. Lipids in Health and Disease. Т. 19, № 1. с. 164. doi:10.1186/s12944-020-01342-3. ISSN 1476-511X. PMC 7350193. PMID 32646451. Процитовано 19 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Seval, Y.; Korgun, E. T.; Demir, R. (2007-08). Hofbauer cells in early human placenta: possible implications in vasculogenesis and angiogenesis. Placenta. Т. 28, № 8-9. с. 841—845. doi:10.1016/j.placenta.2007.01.010. ISSN 0143-4004. PMID 17350092. Процитовано 19 січня 2021.
- ↑ Turk, J. L.; Narayanan, R. B. (1 січня 1982). The Origin, Morphology, and Function of Epithelioid Cells. Immunobiology (англ.). Т. 161, № 3. с. 274—282. doi:10.1016/S0171-2985(82)80083-1. ISSN 0171-2985. Процитовано 19 січня 2021.
- ↑ Hotamisligil, Gökhan S. (2010-04). Endoplasmic reticulum stress and atherosclerosis. Nature Medicine. Т. 16, № 4. с. 396—399. doi:10.1038/nm0410-396. ISSN 1546-170X. PMC 2897068. PMID 20376052. Процитовано 19 січня 2021.
- ↑ Oh, Jisu; Riek, Amy E.; Weng, Sherry; Petty, Marvin; Kim, David; Colonna, Marco; Cella, Marina; Bernal-Mizrachi, Carlos (6 квітня 2012). Endoplasmic reticulum stress controls M2 macrophage differentiation and foam cell formation. The Journal of Biological Chemistry. Т. 287, № 15. с. 11629—11641. doi:10.1074/jbc.M111.338673. ISSN 1083-351X. PMC 3320912. PMID 22356914. Процитовано 19 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Steinman, R. M.; Cohn, Z. A. (1 травня 1973). Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. The Journal of Experimental Medicine. Т. 137, № 5. с. 1142—1162. doi:10.1084/jem.137.5.1142. ISSN 0022-1007. PMC 2139237. PMID 4573839. Процитовано 19 січня 2021.
- ↑ Patente, Thiago A.; Pinho, Mariana P.; Oliveira, Aline A.; Evangelista, Gabriela C. M.; Bergami-Santos, Patrícia C.; Barbuto, José A. M. (2019). Human Dendritic Cells: Their Heterogeneity and Clinical Application Potential in Cancer Immunotherapy. Frontiers in Immunology (English) . Т. 9. doi:10.3389/fimmu.2018.03176. ISSN 1664-3224. Процитовано 19 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Iannello, Alexandre; Debbeche, Olfa; Samarani, Suzanne; Ahmad, Ali (2008-07). Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. Journal of Leukocyte Biology. Т. 84, № 1. с. 1—26. doi:10.1189/jlb.0907650. ISSN 0741-5400. PMID 18388298. Процитовано 23 січня 2021.
- ↑ Vivier, Eric; Raulet, David H.; Moretta, Alessandro; Caligiuri, Michael A.; Zitvogel, Laurence; Lanier, Lewis L.; Yokoyama, Wayne M.; Ugolini, Sophie (7 січня 2011). Innate or adaptive immunity? The example of natural killer cells. Science (New York, N.Y.). Т. 331, № 6013. с. 44—49. doi:10.1126/science.1198687. ISSN 1095-9203. PMC 3089969. PMID 21212348. Процитовано 23 січня 2021.
- ↑ Kruse, Philip H.; Matta, Jessica; Ugolini, Sophie; Vivier, Eric (2014-03). Natural cytotoxicity receptors and their ligands. Immunology and Cell Biology. Т. 92, № 3. с. 221—229. doi:10.1038/icb.2013.98. ISSN 1440-1711. PMID 24366519. Процитовано 23 січня 2021.
- ↑ Rahim, Mir Munir A.; Tu, Megan M.; Mahmoud, Ahmad Bakur; Wight, Andrew; Abou-Samra, Elias; Lima, Patricia D. A.; Makrigiannis, Andrew P. (2014). Ly49 receptors: innate and adaptive immune paradigms. Frontiers in Immunology. Т. 5. с. 145. doi:10.3389/fimmu.2014.00145. ISSN 1664-3224. PMC 3980100. PMID 24765094. Процитовано 23 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Schenkel, Alan Rowe; Kingry, Luke C.; Slayden, Richard A. (2013). The ly49 gene family. A brief guide to the nomenclature, genetics, and role in intracellular infection. Frontiers in Immunology. Т. 4. с. 90. doi:10.3389/fimmu.2013.00090. ISSN 1664-3224. PMC 3627126. PMID 23596445. Процитовано 23 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Pegram, Hollie J.; Andrews, Daniel M.; Smyth, Mark J.; Darcy, Phillip K.; Kershaw, Michael H. (2011-02). Activating and inhibitory receptors of natural killer cells. Immunology and Cell Biology. Т. 89, № 2. с. 216—224. doi:10.1038/icb.2010.78. ISSN 1440-1711. PMID 20567250. Процитовано 23 січня 2021.
- ↑ Iannello, Alexandre; Debbeche, Olfa; Samarani, Suzanne; Ahmad, Ali (2008-07). Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. Journal of Leukocyte Biology. Т. 84, № 1. с. 1—26. doi:10.1189/jlb.0907650. ISSN 0741-5400. PMID 18388298. Процитовано 23 січня 2021.
- ↑ Lodoen, Melissa B.; Lanier, Lewis L. (2005-01). Viral modulation of NK cell immunity. Nature Reviews. Microbiology. Т. 3, № 1. с. 59—69. doi:10.1038/nrmicro1066. ISSN 1740-1526. PMID 15608700. Процитовано 23 січня 2021.
- ↑ Pfefferle, Aline; Jacobs, Benedikt; Haroun-Izquierdo, Alvaro; Kveberg, Lise; Sohlberg, Ebba; Malmberg, Karl-Johan (2020). Deciphering Natural Killer Cell Homeostasis. Frontiers in Immunology. Т. 11. с. 812. doi:10.3389/fimmu.2020.00812. ISSN 1664-3224. PMC 7235169. PMID 32477340. Процитовано 23 січня 2021.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г Murphy, Kenneth (Kenneth M.); Walport, Mark.; Janeway, Charles. (2012). Janeway's immunobiology (вид. 8th ed). New York: Garland Science. ISBN 978-0-8153-4243-4. OCLC 733935898.
- ↑ Chung, James B.; Silverman, Michael; Monroe, John G. (2003-06). Transitional B cells: step by step towards immune competence. Trends in Immunology. Т. 24, № 6. с. 343—349. doi:10.1016/s1471-4906(03)00119-4. ISSN 1471-4906. PMID 12810111. Процитовано 25 січня 2021.
- ↑ Crotty, Shane (2015-03). A brief history of T cell help to B cells. Nature Reviews. Immunology. Т. 15, № 3. с. 185—189. doi:10.1038/nri3803. ISSN 1474-1741. PMC 4414089. PMID 25677493. Процитовано 25 січня 2021.
- ↑ а б в Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (2015-03). The generation of antibody-secreting plasma cells. Nature Reviews. Immunology. Т. 15, № 3. с. 160—171. doi:10.1038/nri3795. ISSN 1474-1741. PMID 25698678. Процитовано 25 січня 2021.
- ↑ MacLennan, Ian C. M.; Toellner, Kai-Michael; Cunningham, Adam F.; Serre, Karine; Sze, Daniel M.-Y.; Zúñiga, Elina; Cook, Matthew C.; Vinuesa, Carola G. (2003-08). Extrafollicular antibody responses. Immunological Reviews. Т. 194. с. 8—18. doi:10.1034/j.1600-065x.2003.00058.x. ISSN 0105-2896. PMID 12846803. Процитовано 25 січня 2021.
- ↑ Shlomchik, Mark J.; Weisel, Florian (2012-05). Germinal center selection and the development of memory B and plasma cells. Immunological Reviews. Т. 247, № 1. с. 52—63. doi:10.1111/j.1600-065X.2012.01124.x. ISSN 1600-065X. PMID 22500831. Процитовано 25 січня 2021.
- ↑ Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (2015-03). The generation of antibody-secreting plasma cells. Nature Reviews. Immunology. Т. 15, № 3. с. 160—171. doi:10.1038/nri3795. ISSN 1474-1741. PMID 25698678. Процитовано 25 січня 2021.
- ↑ T-cell activation | British Society for Immunology. www.immunology.org (англ.). Процитовано 11 березня 2021.
- ↑ Bettelli, Estelle; Carrier, Yijun; Gao, Wenda; Korn, Thomas; Strom, Terry B.; Oukka, Mohamed; Weiner, Howard L.; Kuchroo, Vijay K. (2006-05). Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature (англ.). Т. 441, № 7090. с. 235—238. doi:10.1038/nature04753. ISSN 0028-0836. Процитовано 11 березня 2021.
- ↑ О.Д. Луцик, А.Й. Іванова,К.С. Кабак, Ю.Б. Чайковський (2003). Гістологія людини. Київ: Книга плюс. с. 145—157.
- ↑ https://www.cancer.gov/publications/dictionaries/cancer-terms/def/white-blood-cell. www.cancer.gov (англ.). 2 лютого 2011. Процитовано 5 січня 2021.
- ↑ а б в г д Про що говорить загальний аналіз крові? | Медіс. www.medis.com.ua. Процитовано 4 січня 2021.
- ↑ а б в High white blood cell count Causes. Mayo Clinic (англ.). Процитовано 5 січня 2021.
- ↑ Low white blood cell count Causes. Mayo Clinic (англ.). Процитовано 5 січня 2021.
- ↑ Low White Blood Cell Count. WebMD (англ.). Процитовано 5 січня 2021.

