Нітритна кислота
| Азотиста кислота | |
|---|---|
| |
| Ідентифікатори | |
| Номер CAS | 7782-77-6 |
| Номер EINECS |
231-963-7 |
| DrugBank |
DB09112 |
| KEGG |
C00088 |
| Назва MeSH |
D01.029.260.575 і D01.625.600 |
| ChEBI |
25567 |
| SMILES |
N(=O)O[1] |
| InChI |
InChI=1S/HNO2/c2-1-3/h(H,2,3) |
| Номер Гмеліна |
983 |
| Властивості | |
| Молекулярна формула | HNO2 |
| Молярна маса | 47,0134 г/моль |
| Густина | 1,685 г/см³ |
| Тпл | 42,35 °C |
| Ткип | 158 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Азо́тиста кислота́ (нітритна кислота) — HNO2 — одноосновна слабка кислота, відома лише в розбавлених водних розчинах та в газовій формі. Солі азотистої кислоти називаються нітритами. Нітрити набагато стійкіші, ніж сама кислота, всі вони токсичні.
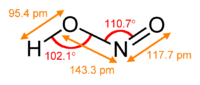
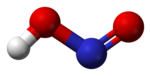
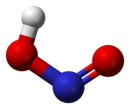
У газовій фазі планарна молекула азотистої кислоти існує у вигляді двох конфігурацій цис- і транс-. При кімнатній температурі переважає транс-ізомер.
 |
 |
Азотисту кислоту отримують розчиненням оксиду азоту(IV) у воді:
- 2NO2 + H2O = HNO2 + HNO3
Або азотистого ангідриду:
- N2O3 + H2O = 2HNO2
Щойно утворений розчин азотної кислоти має блакитне забарвлення і швидко розкладається:
- 2 NO2 + H2O → HNO3 + HNO2
Нагрітий, концентрований розчин розкладається з утворенням азотної кислоти:
- 3 HNO2 → HNO3 + 2 NO + H2O
HNO2 у водних розчинах дисоціює (KD=4,6× 10-4), трохи сильніше оцтової кислоти. Легко витісняється сильнішими кислотами з солей:
- H2SO4 + NaNO2 → NaHSO4 + HNO2.
Азотиста кислота може окислитися сильними окисниками до нітратів, наприклад, перманганатом калію.[2]
- 3 H2SO4 + 2 KMnO4 + 5 KNO2 → 5 KNO3 + 3 H2O + 2 MnSO4 + K2SO4
В результаті реакції можуть утворюватися різні продукти реакції в залежності від окисника: З іонами I− та Fe2+, утворюється газ NO:
- 2 KNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 KNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + K2SO4
З Sn2+,утворюється газ N2O:
- 2 KNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 6 H2O + 2 KCl
З SO2, утворюється NH2OH :
- 2 KNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
З Zn в лужному розчині, утворюється NH3 :
- 5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn(OH)2
З N2H+
5, HN3,утворюється чистий N2:
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
Азотиста кислота використовується для отримання діазонових солей:
- HNO2 + ArNH2 + H+ → ArN+
2 + 2 H2O
де Ar — це арильна група.
Такі солі широко застосовуються в органічному синтезі, реакції Зандмейера та отриманні азосполук, яскраво-забарвлених речовин, які застосовуються як якісний реактив на анілін.[3] Азотиста кислота використовується для знешкодження азиду натрію, надзвичайно токсичної та вибухонебезпечної сполуки. Через неможливість транспортування кислоту готують in situ реакцією кислоти та нітриту натрію:[4]
- NaNO2 + HCl → HNO2 + NaCl
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Реакцією азотної кислоти з двома α-водневими атомами в кетонах одержують оксими, які можуть далі окислюватися до карбонової кислоти. Цей процес використовується в промисловому виробництві адипінової кислоти. Азотиста кислота швидко реагує з аліфатичними спиртами з утворенням алкіл нітритів, які є потужними судинорозширювачами:
- (CH3)2CH-CH2-CH2-OH + HNO2 → (CH3)2CH-CH2-CH2-ONO + H2O
- ↑ NITROUS ACID
- ↑ Inorganic Chemistry, 3rd Edition. — 2008. — ISBN 978-0-13-175553-6.
- ↑ Clarke, H. T.; Kirner, W. R. «Methyl Red» Organic Syntheses, Collected Volume 1, p.374 (1941). http://www.orgsyn.org/orgsyn/pdfs/CV1P0374.pdf [Архівовано 30 вересня 2007 у Wayback Machine.]
- ↑ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. ISBN 0309052297.
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Азотиста кислота // Велика українська енциклопедія : у 30 т. / проф. А. М. Киридон (відп. ред.) та ін. — 2016. — Т. 1 : А — Акц. — 592 с. — ISBN 978-617-7238-39-2.
- КИСЛОТА НІТРИТНА //Фармацевтична енциклопедія
