Синтетична геноміка

Синтетична геноміка — це галузь синтетичної біології, яка використовує аспекти генетичної модифікації вже існуючих форм життя або штучний синтез генів для створення нової ДНК або цілих форм життя.
Синтетична геноміка може відіграти важливу роль у лікуванні генетичних захворювань людини, надаючи інструменти для точного редагування геному та генної терапії.[1]
Синтетична геноміка, зокрема, використовує сконструйовані генні схеми для програмування живих клітин, підвищуючи точність і ефективність біотехнологічних застосувань, таких як генотерапія, цільова доставка ліків, метаболічна і мікробіомна інженерія, а також синтез біоматеріалу. Механістичне моделювання та методи машинного навчання використовуються в поєднанні з синтетичною геномікою, перевіряючи призначені функції та покращуючи швидкість і точність прогнозів.[2]
Синтетична геноміка відрізняється від генетичної інженерії в тому сенсі, що вона не використовує природні гени у створенні форм життя. Синтетична геноміка може використовувати спеціально розроблені серії пар основ, хоча в більш розширеному та наразі нереалізованому сенсі синтетична геноміка може використовувати генетичні коди, які не складаються з двох пар основ ДНК, які зараз використовуються життям.
Здатність конструювати довгі ланцюги пар основ дешево і точно у великих масштабах дозволила дослідникам проводити експерименти з геномами, яких не існує в природі. У поєднанні з розвитком моделей згортання білка та зменшенням обчислювальних витрат синтетична геноміка починає вступати в продуктивну стадію існування.
У 2010 році дослідникам вперше вдалося створити синтетичний організм[3]. Цей прорив був здійснений компанією Synthetic Genomics, Inc., яка продовжує спеціалізуватися на дослідженні та комерціалізації спеціально розроблених геномів.[4] Це було досягнуто шляхом синтезу геному розміром 600 кбіт (схожого на геном Mycoplasma genitalium, за винятком вставки кількох водяних знаків) за допомогою методу збірки Гібсона та рекомбінації, пов’язаної з трансформацією.[5]
Синтетична геноміка може відіграти важливу роль у лікуванні генетичних захворювань людини, надаючи інструменти для точного редагування геному та генотерапії. Одним із основних застосувань синтетичної геноміки є розробка генної терапії, яка передбачає введення здорових копій генів у клітини для заміни або доповнення несправних генів. Методи синтетичної геноміки можна використовувати для розробки та синтезу індивідуальних послідовностей ДНК, які можна використовувати як вектори для доставки терапевтичних генів у клітини.
Крім того, синтетичну геноміку також можна використовувати для точного редагування генома клітин шляхом додавання, видалення або модифікації певних генів. Цей підхід можна використовувати для виправлення генетичних мутацій, які викликають захворювання, або для створення клітин з новими чи покращеними функціями.
Одним із перспективних застосувань синтетичної геноміки в генній терапії є використання технології редагування генів CRISPR-Cas9, яка дозволяє вносити високоточні та цілеспрямовані модифікації геному. CRISPR-Cas9 вже успішно використовувався для лікування генетичних захворювань у тварин, і тривають клінічні випробування, які перевіряють його безпеку та ефективність на людях.
Загалом, синтетична геноміка має великі перспективи для розробки нових та ефективних методів лікування широкого спектру генетичних захворювань, хоча необхідні додаткові дослідження та розробки, перш ніж ці методи можна буде регулярно використовувати в клінічних умовах.
Незабаром після відкриття рестрикційних ендонуклеаз і лігаз галузь генетики почала використовувати ці молекулярні інструменти для збирання штучних послідовностей із менших фрагментів синтетичної або природної ДНК. Перевага у використанні рекомбінаторного підходу на відміну від безперервного синтезу ДНК випливає із зворотного зв’язку, який існує між довжиною синтетичної ДНК та відсотком чистоти цієї синтетичної довжини. Іншими словами, у міру того як синтезуються довші послідовності, кількість клонів, що містять помилки, зростає через притаманну частоту помилок поточних технологій.[6]
Хоча технологія рекомбінантної ДНК частіше використовується для конструювання злитих білків і плазмід, вже з’явилося кілька методів з більшою потужністю, що дозволяє конструювати цілі геноми.[7]

Полімеразна циклічна збірка (PCA) використовує серію олігонуклеотидів довжиною приблизно 40-60 нуклеотидів, які разом складають обидва ланцюги ДНК, що синтезується. Ці олігонуклеотиди розроблені таким чином, що один олігонуклеотид з одного ланцюга містить довжину приблизно 20 нуклеотидів на кожному кінці, що є комплементарним до послідовностей двох різних олігонуклеотидів на протилежному ланцюзі, таким чином створюючи ділянки перекриття. Весь набір обробляється за допомогою циклів: (a) гібридизація при 60°C; (b) подовження за допомогою полімерази Taq і стандартної лігази; і (c) денатурація при 95°C, утворюючи все довші безперервні ланцюги, що зрештою призводить до остаточного синтезованого геному.[8]
PCA був використаний для створення першого в історії синтетичного геному вірусу Phi X 174.[9]

Метод збірки Гібсона, розроблений Деніелом Гібсоном під час його роботи в Інституті Дж. Крейга Вентера, потребує набору дволанцюгових касет ДНК, які складають весь геном, що синтезується. Касети відрізняються від контигів за визначенням тим, що ці послідовності містять ділянки гомології з іншими касетами для цілей рекомбінації. На відміну від Збірки полімеразного циклу, Метод збірки Гібсона є одноетапною ізотермічною реакцією з більшою ємністю послідовності; отже, він використовується замість збірки полімеразного циклу для геномів розміром понад 6 кб.
Екзонуклеаза Т5 виконує реакцію зворотного жування на кінцевих сегментах, працюючи в напрямку від 5' до 3', таким чином створюючи комплементарні виступи. Виступи гібридизуються один з одним, ДНК-полімераза Phusion заповнює всі відсутні нуклеотиди, а виїмки запечатуються лігазою. Однак кількість геномів, які можна синтезувати лише за допомогою цього методу, обмежена, оскільки коли касети ДНК збільшуються в довжину, вони вимагають розмноження in vitro для продовження гібридизації; відповідно, збирання Гібсона часто використовується в поєднанні з рекомбінацією, пов'язаною з перетворенням (див. нижче), щоб синтезувати геноми розміром у кілька сотень кілобаз.[10]

Метою технології трансформація-асоційованної рекомбінації (TAR) у синтетичній геноміці є об’єднання контигів ДНК за допомогою гомологічної рекомбінації, що виконується дріжджовою штучною хромосомою (YAC). Важливим є елемент CEN у векторі YAC, який відповідає центромері дріжджів. Ця послідовність надає вектору здатність поводитися хромосомним чином, таким чином дозволяючи йому виконувати гомологічну рекомбінацію.[11]
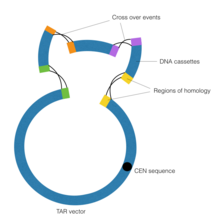
Спочатку виконується клонування репарації розриву для створення ділянок гомології, фланкуючих контиги ДНК.
Клонування з відновленням розривів — це особлива форма полімеразної ланцюгової реакції, у якій використовуються спеціалізовані праймери з розширеннями, що виходять за межі послідовності ДНК-мішені.[12] Потім касети ДНК піддаються впливу вектора YAC, який керує процесом гомологічної рекомбінації, таким чином з’єднуючи касети ДНК.
Технологія Polymerase Cycling Assembly та технологія TAR були використані разом для побудови генома Mycoplasma genitalium розміром 600 кб у 2008 році, першого в історії синтетичного організму.[13] Подібні кроки були зроблені для синтезу більшого генома Mycoplasma mycoides через кілька років[14]
Неприродна пара основ (UBP) — це розроблена субодиниця (або нуклеооснова ) ДНК, яка створюється в лабораторії та не зустрічається в природі. У 2012 році група американських вчених під керівництвом Флойда Е. Ромесберга, біолога-хіміка з Науково-дослідного інституту Скріппса в Сан-Дієго, Каліфорнія, опублікувала, що його команда розробила неприродну пару основ (UBP).[15] Два нових штучних нуклеотиди або неприродна пара основ (UBP) були названі d5SICS і dNaM. Ці штучні нуклеотиди, що несуть гідрофобні нуклеооснови, містять два злитих ароматичних кільця, які утворюють комплекс (d5SICS–dNaM) або пару основ у ДНК.[16][17]
У 2014 році та сама команда з Науково-дослідного інституту Скріппса повідомила, що вони синтезували ділянку кільцевої ДНК — плазміди, що містить природні пари основ T-A і C-G разом із найефективнішою лабораторією UBP Ромесберга, і вставили її в клітини звичайної бактерії E. coli, яка успішно реплікувала неприродні пари основ у кількох поколіннях.[18] Це перший відомий приклад живого організму, який передає розширений генетичний код наступним поколінням.[16][19] Це було частково досягнуто шляхом додавання підтримуючого гена водоростей, який експресує транспортер нуклеотидного трифосфату, який ефективно імпортує трифосфати як d5SICSTP, так і dNaMTP у бактерії E. coli. [16] Потім природні бактеріальні шляхи реплікації використовують їх для точної реплікації плазміди, що містить d5SICS–dNaM.
Успішне включення третьої пари основ є значним проривом у досягненні мети значного розширення кількості амінокислот, які можуть бути закодовані ДНК, від існуючих 20 амінокислот до теоретично можливих 172, таким чином розширюючи потенціал живих організмів до виробляти нові білки.[18] Штучні ланцюжки ДНК ще нічого не кодують, але вчені припускають, що вони можуть бути розроблені для виробництва нових білків, які можуть мати промислове чи фармацевтичне використання.[20]
У квітні 2019 року вчені з ETH Zurich повідомили про створення першого в світі генома бактерії під назвою Caulobacter ethensis-2.0, створеного повністю за допомогою комп’ютера, хоча спорідненої життєздатної форми C. ethensis-2.0 ще не існує.[21][22]
- Біоінженерія
- Генотерапія
- Редагування генома
- Генетична інженерія
- Синтетична біологія
- Обчислювальна біологія
- Voigt Christopher A. (11 грудня 2020). Synthetic biology 2020–2030: six commercially-available products that are changing our world. Nature Communications (англ.) 11 (1). doi:10.1038/s41467-020-20122-2.
- Schindler Daniel (2020). Genetic Engineering and Synthetic Genomics in Yeast to Understand Life and Boost Biotechnology. Bioengineering (англ.) 7 (4). doi:10.3390/bioengineering7040137.
- Grazioli Simona; Petris Gianluca (2021). Synthetic genomics for curing genetic diseases. Progress in Molecular Biology and Translational Science 182. doi:10.1016/bs.pmbts.2021.02.002.
- Hey Maya; Szymanski Erika A. (1 січня 2022). Following the organism to map synthetic genomics. Biotechnology Notes 3. doi:10.1016/j.biotno.2022.07.001.
- Синтетичні геноми: технології та вплив. Дослідження, проведене в 2004 році для Міністерства Освіти США на цю тему.
- Вплив розвитку синтетичної геноміки: слухання в Комітеті з енергетики та торгівлі Палати представників (США), 111й Конгрес (2010).
- Synthetic genomics for curing genetic diseases (2021)
- Synthetic genomics advances and promise (2022)
- ↑ Grazioli, Simona; Petris, Gianluca (2021). Synthetic genomics for curing genetic diseases. Progress in Molecular Biology and Translational Science. Т. 182. с. 477—520. doi:10.1016/bs.pmbts.2021.02.002. ISSN 1878-0814. PMID 34175051. Процитовано 25 лютого 2023.
- ↑ Şimşek, Emrah; Yao, Yi; Lee, Dongheon; You, Lingchong (2023-06). Toward predictive engineering of gene circuits. Trends in Biotechnology. Т. 41, № 6. с. 760—768. doi:10.1016/j.tibtech.2022.11.001. ISSN 0167-7799. Процитовано 10 червня 2023.
- ↑ Hotz, Robert Lee. Scientists Create Synthetic Organism. Wall Street Journal. ISSN 0099-9660. Процитовано 23 вересня 2015.
- ↑ Synthetic Genomics, Inc. - Our Business. www.syntheticgenomics.com. Процитовано 26 вересня 2015.
- ↑ Montague, Michael G; Lartigue, Carole; Vashee, Sanjay (1 січня 2012). Synthetic genomics: potential and limitations. Current Opinion in Biotechnology. 23 (5): 659—665. doi:10.1016/j.copbio.2012.01.014. PMID 22342755.
- ↑ Montague, Michael G; Lartigue, Carole; Vashee, Sanjay (2012). Synthetic genomics: potential and limitations. Current Opinion in Biotechnology. 23 (5): 659—665. doi:10.1016/j.copbio.2012.01.014. PMID 22342755.
- ↑ Gibson, Daniel (2011). Synthetic Biology, Part B: Computer Aided Design and DNA Assembly; Chapter Fifteen - Enzymatic Assembly of Overlapping DNA Fragments. Academic Press. с. 349—361. ISBN 978-0-12-385120-8.
- ↑ Stemmer, Willem P. C.; Crameri, Andreas; Ha, Kim D.; Brennan, Thomas M.; Heyneker, Herbert L. (16 жовтня 1995). Single-step assembly of a gene and entire plasmid from large numbers of oligodeoxyribonucleotides. Gene. 164 (1): 49—53. doi:10.1016/0378-1119(95)00511-4. PMID 7590320.
- ↑ Smith, Hamilton O.; Hutchison, Clyde A.; Pfannkoch, Cynthia; Venter, J. Craig (23 грудня 2003). Generating a synthetic genome by whole genome assembly: φX174 bacteriophage from synthetic oligonucleotides. Proceedings of the National Academy of Sciences. 100 (26): 15440—15445. Bibcode:2003PNAS..10015440S. doi:10.1073/pnas.2237126100. ISSN 0027-8424. PMC 307586. PMID 14657399.
- ↑ Gibson, Daniel G; Young, Lei; Chuang, Ray-Yuan; Venter, J Craig; Hutchison, Clyde A; Smith, Hamilton O (12 квітня 2009). Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5): 343—345. doi:10.1038/nmeth.1318. PMID 19363495.
- ↑ Kouprina, Natalay; Larionov, Vladimir (1 грудня 2003). Exploiting the yeast Saccharomyces cerevisiae for the study of the organization and evolution of complex genomes. FEMS Microbiology Reviews. 27 (5): 629—649. doi:10.1016/S0168-6445(03)00070-6. ISSN 1574-6976. PMID 14638416.
- ↑ Marsischky, Gerald; LaBaer, Joshua (15 жовтня 2004). Many Paths to Many Clones: A Comparative Look at High-Throughput Cloning Methods. Genome Research. 14 (10b): 2020—2028. doi:10.1101/gr.2528804. ISSN 1088-9051. PMID 15489321.
- ↑ Gibson, Daniel G.; Benders, Gwynedd A.; Andrews-Pfannkoch, Cynthia; Denisova, Evgeniya A.; Baden-Tillson, Holly; Zaveri, Jayshree; Stockwell, Timothy B.; Brownley, Anushka; Thomas, David W. (29 лютого 2008). Complete Chemical Synthesis, Assembly, and Cloning of a Mycoplasma genitalium Genome. Science. 319 (5867): 1215—1220. Bibcode:2008Sci...319.1215G. doi:10.1126/science.1151721. ISSN 0036-8075. PMID 18218864.
- ↑ Gibson, Daniel G.; Glass, John I.; Lartigue, Carole; Noskov, Vladimir N.; Chuang, Ray-Yuan; Algire, Mikkel A.; Benders, Gwynedd A.; Montague, Michael G.; Ma, Li (2 липня 2010). Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome. Science. 329 (5987): 52—56. Bibcode:2010Sci...329...52G. doi:10.1126/science.1190719. ISSN 0036-8075. PMID 20488990.
- ↑ Malyshev, Denis A.; Dhami, Kirandeep; Quach, Henry T.; Lavergne, Thomas; Ordoukhanian, Phillip (24 липня 2012). Efficient and sequence-independent replication of DNA containing a third base pair establishes a functional six-letter genetic alphabet. Proceedings of the National Academy of Sciences of the United States of America. 109 (30): 12005—12010. Bibcode:2012PNAS..10912005M. doi:10.1073/pnas.1205176109. PMC 3409741. PMID 22773812.
- ↑ а б в Malyshev, Denis A.; Dhami, Kirandeep; Lavergne, Thomas; Chen, Tingjian; Dai, Nan; Foster, Jeremy M.; Corrêa, Ivan R.; Romesberg, Floyd E. (7 травня 2014). A semi-synthetic organism with an expanded genetic alphabet. Nature. 509 (7500): 385—8. Bibcode:2014Natur.509..385M. doi:10.1038/nature13314. PMC 4058825. PMID 24805238.
- ↑ Callaway, Ewan (7 травня 2014). Scientists Create First Living Organism With 'Artificial' DNA. Nature News. Huffington Post. Процитовано 8 травня 2014.
- ↑ а б BRADLEY J. FIKES (7 травня 2014). Life engineered with expanded DNA code. San Diego Union-Tribune (амер.). Процитовано 25 лютого 2023.
- ↑ Sample, Ian (7 травня 2014). First life forms to pass on artificial DNA engineered by US scientists. The Guardian. Процитовано 8 травня 2014.
- ↑ Pollack, Andrew (7 травня 2014). Scientists Add Letters to DNA's Alphabet, Raising Hope and Fear. New York Times. Процитовано 8 травня 2014.
- ↑ ETH Zurich (1 квітня 2019). First bacterial genome created entirely with a computer.
- ↑ Venetz, Jonathan E. та ін. (1 квітня 2019). Chemical synthesis rewriting of a bacterial genome to achieve design flexibility and biological functionality. Proceedings of the National Academy of Sciences of the United States of America. 116 (16): 8070—8079. doi:10.1073/pnas.1818259116. PMC 6475421. PMID 30936302.