Терапія з використанням моноклональних антитіл
Терапія з використанням моноклональних антитіл — метод в імунотерапії, який використовує моноклональні антитіла (mAb) для моноспецифічного зв'язування з певними клітинами або білками. Таке лікування стимулює імунну систему організму атакувати вибрані клітини. Також існує метод лікування в радіоімунотерапії, при якому пацієнти приймають моноклональні антитіла, мічені певними радіоактивними ізотопами, що локалізують мічену клітинну лінію, призводячи до загибелі уражених клітин.[1] Раніше, антитіла використовували для зв'язування з молекулами, які беруть участь у регуляції Т-клітин, для видалення гальмівних шляхів, що блокують імунну відповідь Т-клітин. Цей метод відомий як «чек-поінт терапія».[2]
Можна створити mAb, специфічні майже для будь-якої мішені позаклітинного чи клітинного простору. В останні роки проводяться дослідження та розробки для створення антитіл до таких захворювань, як ревматоїдний артрит, розсіяний склероз, хвороба Альцгеймера, Ебола[3] та різних видів раку.
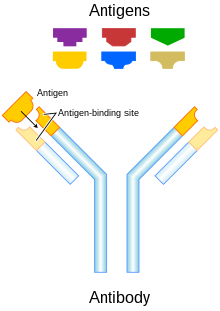
Антитіла, або імуноглобуліни G (IgG) — це великі гетеродимерні молекули, за розміром приблизно 150 кДа специфічність антитіл, вбудованих у константні ділянки. Чотири відомі підкласи IgG задіяні у антитіло-залежній клітинній цитотоксичності.[4] Антитіла є ключовим компонентом адаптивної імунної відповіді, відіграючи центральну роль як у розпізнаванні чужорідних антигенів, так і в стимулюванні імунної відповіді на них. Поява технології моноклональних антитіл дозволила підвищити активність антитіл проти специфічних антигенів, наявних на поверхнях пухлин.[5] Моноклональні антитіла можуть бути набуті в імунній системі через пасивний або активний імунітет. Перевагою активної терапії з застосуванням моноклональних антитіл є той факт, що імунна система виробляє антитіла довгостроково, а ліки вводяться за короткий термін, щоб викликати цю реакцію. Однак імунна відповідь на певні антигени може бути недостатньою, особливо у літніх людей. Крім того, побічні реакції від цих антитіл можуть виникнути через тривалу реакцію на антигени.[6] Пасивна терапія моноклональними антитілами може забезпечити послідовне накопичення антитіл і може контролювати побічні реакції шляхом припинення введення. Основними недоліками цієї терапії є необхідність багаторазового введення та висока вартість.
Терапія моноклональними антитілами може бути корисною в клінічній медицині для раку, аутоімунних захворювань та неврологічних порушень, які призводять до дегенерації клітин, наприклад, хвороби Альцгеймера. Терапія моноклональними антитілами може допомогти імунній системі, оскільки вроджена імунна система реагує на фактори навколишнього середовища, з якими стикається, розрізняючи чужорідні клітини від клітин організму. Отже, пухлинні клітини, що проліферують з високою швидкістю, або клітини тіла, які гинуть, що в подальшому спричиняє фізіологічні проблеми, як правило, спеціально не спрямовані на імунну систему, оскільки пухлинні клітини є власними клітинами організму. Пухлинні клітини, однак, є аномальними, і багато клітин проявляють незвичайні антигени. Деякі такі пухлинні антигени є невідповідними для типу клітини або її середовища. Моноклональні антитіла можуть мітити пухлинні клітини або аномальні клітини в організмі, що ідентифіковані як клітинини організму, але мають негативний вплив.
Радіоімунотерапія передбачає використання радіоактивно-кон'югованих мишачих антитіл проти клітинних антигенів. Більшість досліджень передбачає їх застосування до лімфом, оскільки це високочутливі злоякісні утворення. Для обмеження радіаційного впливу були обрані мишачі антитіла, оскільки їх висока імуногенність сприяє швидкому кліренсу пухлини.
Антитіло-спрямована ферментна лікувальна терапія передбачає застосування рак-асоційованих моноклональних антитіл, пов'язаних з ферментом, активованим лікарським препаратом. Системне введення нетоксичного агента призводить до перетворення антитіла в токсичні ліки, що призводить до цитотоксичного ефекту, який може бути направлений на злоякісні клітини. Клінічний успіх лікування цим типом обмежений.[7]
Антитіло-лікарські кон'югати (АЛК) — це антитіла, пов'язані з однією або декількома молекулами препарату. Зазвичай, коли АЛК зустрічається з клітиною-мішенню (наприклад, раковою клітиною), лікарський засіб випускається для його знищення. Багато АЛК знаходяться на доклінічному дослідженні. Станом на 2016 кілька було затверджено.
Імуноліпосоми є кон'югованими антитілами ліпосоми. Ліпосоми можуть переносити лікарські засоби або терапевтичні нуклеотиди і, коли вони кон'югуються з моноклональними антитілами, можуть бути спрямовані проти злоякісних клітин. Імуноліпосоми успішно використовуються in vivo для передачі пухлин-супресуючих генів у пухлини, використовуючи фрагмент антитіла проти рецептора трансферину людини. У тканинах раку мозку та молочної залози було досягнуто тканинно-специфічної доставки генів за допомогою імуноліпосом.[8]
Чек-поінт терапія використовує антитіла та інші шляхи для обходу захисних бар'єрів, з допомогою яких пухлини пригнічують імунну систему. Комплексна терапія поєднує антитіла для придушення декількох захисних шарів. Відомі «чек-поінти» включають CTLA-4, націлену іпілімумабом, PD-1, націлену ніволумабом і пембролізумабом, і мікросередовище пухлини.[2]
- ↑ Waldmann TA (March 2003). Immunotherapy: past, present and future. Nature Medicine. 9 (3): 269—77. doi:10.1038/nm0303-269. PMID 12612576. Архів оригіналу за 13 квітня 2021. Процитовано 5 грудня 2019.
- ↑ а б Sharma P, Allison JP (April 2015). The future of immune checkpoint therapy. Science. 348 (6230): 56—61. Bibcode:2015Sci...348...56S. doi:10.1126/science.aaa8172. PMID 25838373.
- ↑ Olinger GG, Pettitt J, Kim D, Working C, Bohorov O, Bratcher B, Hiatt E, Hume SD, Johnson AK, Morton J, Pauly M, Whaley KJ, Lear CM, Biggins JE, Scully C, Hensley L, Zeitlin L (October 2012). Delayed treatment of Ebola virus infection with plant-derived monoclonal antibodies provides protection in rhesus macaques. Proceedings of the National Academy of Sciences of the United States of America. 109 (44): 18030—5. Bibcode:2012PNAS..10918030O. doi:10.1073/pnas.1213709109. PMC 3497800. PMID 23071322.
- ↑ Janeway, Charles; Paul Travers; Mark Walport; Mark Shlomchik (2001). Immunobiology; Fifth Edition. New York and London: Garland Science. ISBN 978-0-8153-4101-7. Архів оригіналу за 28 червня 2009. Процитовано 5 грудня 2019.
- ↑ Janeway CA, Jr. (2005). Immunobiology (вид. 6th). Garland Science. ISBN 978-0-443-07310-6.
- ↑ Baxter, David (December 2007). Active and passive immunity, vaccine types, excipients and licensing. Occupational Medicine. 57 (8): 552—6. doi:10.1093/occmed/kqm110. PMID 18045976.
- ↑ Francis RJ, Sharma SK, Springer C, Green AJ, Hope-Stone LD, Sena L, Martin J, Adamson KL, Robbins A, Gumbrell L, O'Malley D, Tsiompanou E, Shahbakhti H, Webley S, Hochhauser D, Hilson AJ, Blakey D, Begent RH (September 2002). A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6): 600—7. doi:10.1038/sj.bjc.6600517. PMC 2364249. PMID 12237768.
- ↑ Krauss WC, Park JW, Kirpotin DB, Hong K, Benz CC (2000). Emerging antibody-based HER2 (ErbB-2/neu) therapeutics. Breast Disease. 11: 113—24. doi:10.3233/bd-1999-11110. PMID 15687597.