Тример (хімія)
Тример (від грец. trimeres «три частини») — молекула, яка скаладається з трьох мономерів, зв'язаних один з одним ковалентно або слабшими міжмолекулярними взаємодіями (іонний зв'язок, водневий зв'язок або сили Ван-дер-Ваальса). Тримери є різновидом олігомерів. Якщо субодиниці тримера ідентичні, його називають гомотримером. Хімічна реакція з утворенням тримера називається тримеризацією.

У 1866 році Марселлін Бертело повідомив про перший приклад циклотримеризації, перетворення ацетилену в бензол[1]:
Симетричні 1,3,5-триазини отримують тримеризацією нітрилів, таких як хлороціан або бромоціан.
Хлороціан тримеризується при підвищених температурах над вуглецевим каталізатором у ціанурхлорид:
Бромоціан також вступає в екзотермічну реакцію тримеризації з утворенням ціанурброміду. Ця реакція каталізується слідами брому, солей металів, кислот і лугів[2][3].
Промисловий метод отримання ціанурової кислоти відбувається шляхом піролізу сечовини з виділенням аміаку. Перетворення починається приблизно з 175 °C:[4]
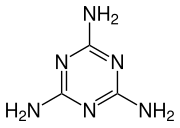
Ендотермічний синтез меламіну можна описати у дві стадії.
Спочатку сечовина розкладається на ціанову кислоту та аміак в ендотермічній реакції:
Потім на другому етапі ціанова кислота тримеризується з утворенням ціанурової кислоти, яка конденсується з вивільненим аміаком на першому етапі з виділенням меламіну та води.
Потім ця вода реагує з присутньою ціановою кислотою, яка сприяє реакції тримеризації, утворюючи вуглекислий газ і аміак.
Загалом другий етап є екзотермічним:
але загальний процес ендотермічний.
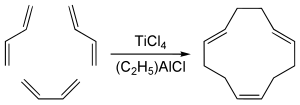
1,5,9-транс-транс-цис-ізомер циклододекатрієну, який має певне промислове значення, отримують шляхом циклотримеризації бутадієну з тетрахлоридом титану та алюмоорганічним каталізатором:[5]
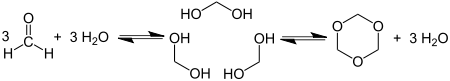
Циклотримеризація формальдегіду дає 1,3,5-триоксан:
1,3,5-тритіан є циклічним тримером тіоформальдегіду. Цей гетероцикл складається з шестичленного кільця з чергуванням метиленових містків і тіоефірних груп. Його отримують шляхом обробки формальдегіду сірководнем[6].
Три молекули ацетальдегіду конденсуються, утворюючи паральдегід, циклічний тример, що містить одинарні зв’язки CO:
При конденсації трьох молекул ацетону під дією концентрованої сульфатної або хлоридної кислоти утворюється симетричний триметилбензол (мезитилен)[7]:
- ↑ Folkins, Hillis O. (2000). Benzene. Ullmann's Encyclopedia of Industrial Chemistry (англ.). John Wiley & Sons, Ltd. doi:10.1002/14356007.a03_475. ISBN 978-3-527-30673-2.
- ↑ Morris, Joel; Kovács, Lajos; Ohe, Kouichi (2015). Cyanogen Bromide. Encyclopedia of Reagents for Organic Synthesis. с. 1—8. doi:10.1002/047084289X.rc269.pub3. ISBN 9780470842898.
- ↑ Joel Morris; Lajos Kovács (2008). Cyanogen Bromide. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc269.pub2. ISBN 978-0471936237.
- ↑ Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a08 191
- ↑ Industrial Organic Chemistry, Klaus Weissermel, Hans-Jurgen Arpe John Wiley & Sons; 3rd 1997 ISBN 3-527-28838-4
- ↑ Bost, R. W.; Constable, E. W. "sym-Trithiane" Organic Syntheses, Collected Volume 2, p.610 (1943). Archived copy (PDF). Архів оригіналу (PDF) за 29 березня 2012. Процитовано 5 травня 2014.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ Cumming, W. M. (1937). Systematic organic chemistry (3E). New York, USA: D. Van Nostrand Company. с. 57.






![{\displaystyle {\ce {3 HOCN -> [C(O)NH]3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6a34f3b03c3ba201baf55fca465c07bf72526c7)
![{\displaystyle {\ce {[C(O)NH]3 + 3 NH3 -> C3H6N6 + 3 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/622a370fe2c00b97f4012e0e3294ddc0741bcc0f)