Мезитилен
| Mesitylene | |
|---|---|
 Mesitylene
|
 Mesitylene
|
| Інші назви | Mesitylene[1] sym-Trimethylbenzene |
| Ідентифікатори | |
| Номер CAS | 108-67-8 |
| PubChem | 7947 |
| Номер EINECS | 203-604-4 |
| KEGG | C14508 |
| ChEBI | 34833 |
| RTECS | OX6825000 |
| SMILES | Cc1cc(cc(c1)C)C |
| InChI | 1/C9H12/c1-7-4-8(2)6-9(3)5-7/h4-6H,1-3H3 |
| Номер Бельштейна | 906806 |
| Номер Гмеліна | 2956 |
| Властивості | |
| Молекулярна формула | C9H12 |
| Молярна маса | 120.19 g/mol |
| Зовнішній вигляд | Clear, colorless liquid[2] |
| Запах | Distinctive, aromatic[2] |
| Густина | 0.8637 g/cm3 at 20 °C |
| Тпл | −44.8 |
| Розчинність (вода) | 0.002% (20°C)[2] |
| Тиск насиченої пари | 2 mmHg (20°C)[2] |
| Структура | |
| Дипольний момент | 0.047 D [3] |
| Небезпеки | |
| ГДК (США) | none[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Мезитилен, або 1,3,5-триметилбензол — похідна бензолу із трьома метильними замісниками, розташованими симетрично навколо кільця. Двома іншими ізомерними триметилбензолами є 1,2,4-триметилбензол (псевдокумол) й 1,2,3-триметилбензол (мемімелітен).
Є компонентом кам'яновугільної смоли, галичанської нафти (разом із бензолом, толуолом, мета- й параксилолами)[4].
Мезитилен є безбарвною рідиною із солодким ароматичним запахом. Температура топлення -44,72 С, кипіння 164,7. Розчинний у органічних розчинниках (ацетон, бензол, діетиловий ефір, хлороформ, етанол). Щільність 0,86518 (20 °C, відносно води при 4 °C, агрегатний стан — рідина).
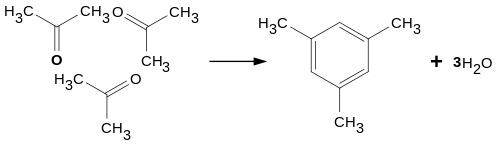
При конденсації трьох молекул ацетону під дією концентрованої сульфатної або хлоридної кислоти утворюється симетричний триметилбензол (мезитилен):
У пропорції 1:1 цей мономолекулярний комплекс не є забарвленим, а його розчини у органічних розчинах не є електропровідними, тобто не містять йонів. Мезитилен (π-основа) утворює із DCl (кислота) за низької температури донорно-акцепторний комплекс, який називається π-комплексом. У цьому комплексі обмін дейтерієм не відбувається.
У присутності кислот Льюїса π-комплекс перетворюється на σ-комплекс, який є забарвленим у жовтий колір, а його розчини у органічних розчинниках є електропровідними.
У мезитилені атоми водню ароматичного кільця швидко обмінюються на дейтерій. Термодинамічна стабільність σ-комплексів такого типу (аренонієвих йонів, бензолонєвих катіонів) у значній мірі залежить від будови початкового субстрату та від природи протиіону. Уведення електродонорних замісників у ароматичне кільце підвищує термодинамічну стабільність відповідних σ-комплексів. Такий самий вплив мають слабоосновні комплесні протиіони, наприклад,
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. с. 139. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ а б в г д NIOSH Pocket Guide to Chemical Hazards #0639. Національний інститут охорони праці (NIOSH).
- ↑ Zhao, Jun; Zhang, Renyi (2004). Proton transfer reaction rate constants between hydronium ion (H3O+) and volatile organic compounds. Atmospheric Environment. 38 (14): 2177—2185. doi:10.1016/j.atmosenv.2004.01.019.
- ↑ В.В.Марковников, Бальштайн, 1922, V, 280.