Хімічна сполука
| Хімічна сполука | |
| Досліджується в |
хімія |
|---|---|
| Метаклас для |
хімічна речовина |
| | |
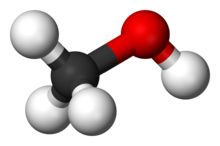
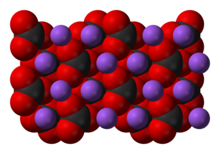
Хімі́чна сполу́ка — речовина, молекули якої складаються з атомів двох або більше різних хімічних елементів, сполучених між собою тим чи іншим типом хімічного зв'язку. Сполука має певний хімічний склад і їй можна приписати точну хімічну формулу.
Хімічні сполуки відрізняються від простих речовин тим, що до їхнього складу входять атоми різних хімічних елементів. На відміну від сумішей хімічних елементів, хімічна сполука має якісно нові властивості, які не зводяться до властивостей хімічних елементів, що входять до її складу.
Поняття хімічна сполука ідеалізоване: на відміну від реальних хімічних речовин, більшість з яких є сумішами різних хімічних сполук. Хімічні речовини, що мають у своєму складі практично тільки одну хімічну сполуку, називають чистими.
Зазвичай, структурною одиницею хімічної сполуки є молекула, хімічний склад та будова якої може визначатися певною хімічною формулою. Однак існують речовини немолекулярної будови і навіть сполуки змінного складу (бертоліди). В таких випадках, коли структурну одиницю складно визначити чи важко собі уявити, склад сполуки виражають формульною одиницею.
Оскільки до складу сполуки входять різні хімічні елементи, відповідні речовини називають складними. Складних речовин незрівнянно більше, ніж простих. Якщо простих речовин тепер відомо понад 500 (це більше за кількість елементів внаслідок алотропії), то складних речовин в неорганічній хімії — понад 50 тисяч, а в органічній хімії — близько 3 млн.
До складних речовин належать, наприклад, вода — H2O, молекули якої складаються з двох атомів водню і одного атома кисню, сульфатна кислота — H2SO4, молекули якої складаються з двох атомів водню, одного атома сірки і чотирьох атомів кисню тощо.
Сполука може бути такою, як вода, коли зв'язок утримується завдяки спільній парі електронів (ковалентний зв'язок), або іонною, коли зв'язок утворюється завдяки притяганню протилежних зарядів (іонний зв'язок), як наприклад хлорид натрію.
Сполуки можуть знаходитися в різних фазах. Всі сполуки можуть існувати у твердому стані. Речовини можуть бути рідиною, газом або плазмою. Вони можуть розпадатися до сполук з меншою кількістю атомів в молекулі при температурі розкладу або до атомів при вищих температурах (як в атомно-абсорбційному аналізі).


З певного набору хімічних елементів можуть утворюватися різні хімічні сполуки, в залежності від того, в якій кількості та яким чином з'єднані між собою атоми. Наприклад, вуглець та кисень можуть утворити чадний газ CO або вуглекислий газ CO2.
Часто хімічну сполуку можна однозначно ідентифікувати за її хімічною формулою, яка вказує скільки атомів якого сорту входять до складу сполуки, наприклад: аміак: NH3. Більше інформації дає структурна формула, в якій вказані не тільки типи атомів, а й те, як вони з'єднані між собою. Сполуки з однаковим атомним складом, але із різною структурною формулою, а, отже, різними хімічними властивостями, називаються ізомерами.
Важливою загальною характеристикою хімічних сполук є їхня молекулярна маса, яку можна обчислити як суму атомних мас усіх атомів, що входять до складу формульної одиниці хімічної сполуки.
Для формулювання поняття про хімічну сполуку важливе значення мав закон сталості складу, відкритий Жозефом Прустом у 1799[1]. Цей закон стверджує, що незалежно від того, яким чином утворилася певна хімічна речовина, вона завжди містить одні й ті ж хімічні елементи, причому відношення мас цих елементів виражаються малими цілими числами. Через кілька років, у 1803, Джон Дальтон сформулював закон кратних співвідношень, який стверджував, що у разі, коли з певних елементів можуть утворюватися дві сполуки, з певною масою першого з них сполучаються такі маси другого, відношення яких теж дає мале ціле число[2][3][4]. Ці два відкриття проторували шлях до розуміння атомної будови речовин.
Поняття структурної формули запровадив у 1850-тих німецький хімік Фрідріх Авґуст Кекуле фон Страдоніц[5][6].
Усі хімічні сполуки, яких нараховується близько 17 мільйонів, поділяють на два великі класи: органічні сполуки (більше ніж 16 мільйонів) й неорганічні сполуки. Відповідно до цього поділу в хімії елементів існують два розділи: органічна хімія та неорганічна хімія. До органічних сполук входять майже всі сполуки, які містять вуглець, крім найпростіших. Назва органічні пов'язана з ранніми уявленнями, що такі сполуки утворюються й існують лише в живих організмах.
Інший тип поділу хімічних сполук пов'язаний із їхніми хімічними властивостями, зумовленими певними хімічними елементами та функціональними групами, що входять до їхнього складу. В залежності від типів електролітів, які хімічні сполуки утворюють, розчиняючись у воді, хімічні сполуки поділяються на кислоти, основи та солі. Для кислот, як органічних, так і неорганічних, характерне відщеплення протона H+, тоді як від основ при дисоціації відокремлюється функціональна група, гідроксид-іон, OH–.
Залежно від наявності в складі хімічної сполуки певних хімічних елементів виділяють окремі групи: гідриди, оксиди, сульфіди тощо.
Органічні сполуки мають свою власну класифікацію. До найбільших груп органічних речовин належать вуглеводні, вуглеводи, спирти, альдегіди, ліпіди, цукри тощо. Окремий клас складають ароматичні сполуки — сполуки з циклічними групами. Завдяки властивостям вуглецю утворювати хімічні зв'язки різної конфігурації, молекули органічних речовин можуть мати вигляд довгих ланцюжків, які називають полімерами чи високомолекулярними сполуками. Такі високомолекулярні сполуки як білки, ДНК та РНК є біохімічною основою життя.
Класифікація за типом хімічного зв'язку
[ред. | ред. код]Виходячи із типу зв'язку між атомами у сполуці можна також виділити чотири типи хімічних сполук:
- молекулярні сполуки (у складі яких один чи більше атомів, як правило неметалу),
- іонні сполуки (з атомів металів і атомів неметалів),
- інтерметалічні сполуки (з атомів металів),
- комплексні сполуки (у складі яких, як правило, катіон, що містить атом(и) метал(у), та молекули або йони, які його оточують).
Звісно, існують і перехідні форми між цими чотирма типами.
Хімічні сполуки можна класифікувати і залежно від присутності в їх складі певної кількості хімічних елементів. Так, бінарні сполуки складаються із двох елементів та мають загальну формулу AxBy. Приміром, хлороводень (HCl), фторид натрію (NaF) чи вода (H2O) складаються із двох елементів, отже, є бінарними хімічними сполуками. Аналогічно до бінарних класифікують і тернарні сполуки, що складаються із трьох елементів. Наприклад, карбонат натрію (Na2CO3), у склад якого входять елементи натрій, вуглець і кисень. Квартернарні (почетвірні) сполуки складаються відповідно із чотирьох елементів. Як приклад — гідрокарбонат натрію NaHCO3, у склад якого входять елементи натрій, вуглець, кисень і четвертий елемент водень.
Багато хімічних сполук мають традиційні назви, що склалися історично, наприклад: вода, вуглекислий газ, сірчана кислота тощо. Однак, більшість хімічних сполук не мають таких назв. Як наслідок, виникла необхідність розробки хімічної номенклатури — правил найменування хімічних сполук, які дозволяли б однозначно назвати будь-яку сполуку, були б міжнародними й якомога краще відображали б структуру речовини. Створенням і підтримкою такої номенклатури опікується Міжнародний союз фундаментальної та прикладної хімії (IUPAC).
В Україні номенклатура хімічних сполук затверджується державними стандартами[7].
Усім хімічним речовинам, а, отже, всім хімічним сполукам, описаним у науковій літературі, присвоюється номер CAS, хімічної реферативної служби, за яким речовину можна ідентифікувати в базах даних, наприклад у PubChem.
- Вещество // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1988. — Т. 1 : Абляционные материалы — Дарзана реакция. — Стб. 698. — Библиогр. в конце ст. — ISBN 5-85270-008-8.(рос.)
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с.
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- СПОЛУКА ХІМІЧНА [Архівовано 8 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- [[https://web.archive.org/web/20180327050536/http://stemua.science/номенклатура-хімічних-речовин-в-укра/ Архівовано 27 березня 2018 у Wayback Machine.]. Шаповалов Є. Б. Номенклатура хімічних речовин в Україні [Електронний ресурс] / Євгений Борисович Шаповалов // http://stemua.science/. – 2017.]
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. Chim., 32:26-54. Excerpt [Архівовано 4 червня 2016 у Wayback Machine.], in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne. Law of Multiple Proportions Problem. 1. Архів оригіналу за 7 грудня 2012. Процитовано 31 січня 2012. [Архівовано 2012-11-07 у Wayback Machine.]
- ↑ Архівована копія. Архів оригіналу за 24 серпня 2012. Процитовано 2 квітня 2012.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ Стаття «Law of multiple proportions» - енциклопедія Britannica (англ.)
- ↑ Aug. Kekulé (1857). Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale. Annalen der Chemie und Pharmacie. 104 (2): 129—150. doi:10.1002/jlac.18571040202.
- ↑ Aug. Kekulé (1858). Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs. Annalen der Chemie und Pharmacie. 106 (2): 129—159. doi:10.1002/jlac.18581060202.
- ↑ Фармацевтична енциклопедія про номенклатуру деяких хімічних сполук. Архів оригіналу за 11 червня 2011. Процитовано 26 червня 2011.
