Оксид заліза(III)
| Оксид заліза(III) | |
|---|---|

| |
| Систематична назва | Ферум(III) оксид |
| Інші назви | Сесквіоксид заліза |
| Ідентифікатори | |
| Номер CAS | 1309-37-1 |
| Номер EINECS | 215-168-2 |
| DrugBank | DB11576 |
| KEGG | C19424 |
| ChEBI | 50819 |
| RTECS | NO7400000 |
| SMILES | [Fe+3].[Fe+3].[O-2].[O-2].[O-2] |
| InChI | InChI=1S/2Fe.3O |
| Номер Гмеліна | 11092 |
| Властивості | |
| Молекулярна формула | Fe2O3 |
| Молярна маса | 159,688 г/моль |
| Зовнішній вигляд | червоно-коричневі кристали |
| Густина | 5,25 г/см³ (α-Fe2O3)[1] |
| Тпл | 1565 °C (α-Fe2O3)[1] |
| Розчинність (вода) | нерозчинний |
| Розчинність (кислоти) | розчинний |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
-824,2 кДж/моль |
| Ст. ентропія S 298 |
87,4 Дж/(моль·К) |
| Теплоємність, c p |
103,9 Дж/(моль·К) |
| Пов'язані речовини | |
| Інші катіони | оксид заліза(II) |
| Інші | гідроксид заліза(III) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Окси́д залі́за(III), фе́рум(III) окси́д — неорганічна сполука складу Fe2O3. Проявляє слабкі амфотерні властивості.
Оксид може існувати у трьох структурних модифікаціях — α-, γ-, δ-Fe2O3, які мають різні властивості та різні методи отримання. Модифікації мають світло-коричневий або червоно-коричневий колір. Fe2O3 широко застосовується як пігмент у виготовленні фарб (див. Сангіна), також використовується у виробництві футеровочної кераміки, цементу й магнітних стрічок.

Fe2O3 є найбільш стійкою кисневмісною сполукою заліза з тих, що зустрічаються у природі. Даний оксид поширений не лише у вільному стані, а й у складі залізних руд. До їхнього числа належать, зокрема, мінерали магнетит (FeO·Fe2O3), гематит (α-Fe2O3), лимоніт (Fe2O3·H2O) тощо.

Оксид заліза(III) здатен перебувати у трьох структурних модифікаціях: α-, γ- та δ-формах. Найбільш поширеною з них є α-модифікація — оксид саме цього типу перебуває у природі у вигляді мінералів. Структуру такої модифікації має, наприклад, мінерал гематит. α-Модифікація утворюється при випалюванні заліза (за температури вище 200 °C) або мінералу піриту FeS2, а також при тривалому нагріванні оксиду у γ-формі. α-Fe2O3 є парамагнітним.
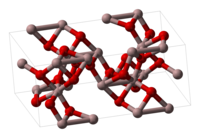
γ-Fe2O3 має структуру типу корунду — мінералу оксиду алюмінію. Дана форма утворюється при низькотемпературному окисненні заліза (нижче 200 °C), при окисненні Fe3O4 або нагріванням α-форми при 300 °C (але за нагрівання вище 400 °C переходить назад у α-форму). γ-Модифікація є феромагнітною.
Модифікація δ-Fe2O3 є феромагнітною та утворюється в розчинах в результаті окиснення сполук Fe(II) лугами.
Оксид заліза(III) отримують окисненням заліза, а також деяких його бінарних сполук, наприклад, мінералу піриту:
Іншим способом є термічне розкладання кисневмісних сполук Fe(II) та Fe(III):
- (утворюються домішки SO3)
Також оксид заліза утворюватиметься при нагріванні його галогенідів у струмені водяної пари:
Fe2O3 є стійкою сполукою, він не розчиняється у воді, амоніаку (не утворює комплексні сполуки). При високотемпературному нагріванні він може розкладатися з утворенням змішаного оксиду Fe3O4
Оксид проявляє слабкі амфотерні властивості: розчиняється у кислотах, а також при сплавленні з лугами й іншими осно́вними сполуками утворює ферати:
Fe2O3 відновлюється воднем та оксидом вуглецю CO:
Оксид заліза може використовуватися у різних галузях, в залежності від його структури. α-Fe2O3 застосовується для отримання чистого заліза, у виготовленні футеровки, цементу, а також поглинальної маси в очистці газів. γ-Модицікація використовується як складова шару магнітних стрічок.
Деякі природні різновиди Fe2O3 застосовують для виготовлення коричневої олійної фарби під технічними назвами «залізний сурик», «вохра», або «мумія».
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1966. — Т. 2. — 833 с. (рос.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : "Мир", 1972. — Т. 2. — 871 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)









![{\displaystyle \mathrm {Fe_{2}O_{3}+6HCl_{(gas)}{\xrightarrow {500^{o}C,[Cl_{2}]}}2FeCl_{3}+3H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f006c93627ab71be3f05b193de4b2209b5311ad0)




![{\displaystyle \mathrm {Fe_{2}O_{3}+ZnO{\xrightarrow {t}}[ZnFe_{2}]O_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ff8b160356ad2a6d3d1c21a25e0caeeab2d3acde)





