Користувач:Jarozwj/Інкубатор/Статті/Чернетка
Слово альдегід було придумане Юстусом фон Лібіхом як скорочення латинського alcohol dehydrogenatus — дегідрогенізований спирт[1] (в деяких джерелах — alcohol dehydrogenatum[2]). Назва радикалу форміл, а також інші спільнокореневі слова (формальдегід, форміати), походять від лат. formica — мураха.
У популярній та науковій літературі можна часто зустріти історичні, або тривіальні, назви альдегідів, які внаслідок усталеної традиції використовуються замість систематичних назв. Тривіальні назви зазвичай походять від назв відповідних карбонових кислот, а також від назви джерела, з якого був виділений той чи інший альдегід. Так, наприклад, формальдегід називають мурашиним альдегідом, етаналь — оцтовим, пентаналь — валер'яновим альдегідом, цитронелаль отримав свою назву, оскільки був виділений із масла цитрусових.
Історично склалося, що парфумери називають багато пахучих речовин альдегідами, навіть ті, які не мають нічого спільного з ними. Серед таких, наприклад, персиковий, суничний[ru] та кокосовий альдегід, які є не альдегідами, а складними ефірами або лактонами. Також деякі альдегіди традиційно називаються за кількістю атомів Карбону, наприклад, персиковий альдегід, який позначається як «альдегід C14», насправді має лише 11 атомів Карбону[3].
За номенклатурою ІЮПАК назви простих альдегідів утворюються від назв відповідних алканів з додаванням суфікса -аль, а діальдегідів — суфікса -діаль (в даному випадку атом Карбону альдегідної групи уже входить до складу родоначального алкана). При цьому в назві номер при альдегідній групі, зазвичай, не ставлять, оскільки вона завжди займає крайнє положення. Якщо карбонільна група не входить в родоначальну структуру (наприклад, якщо родоначальною структурою є циклічний вуглеводень або гетероцикл), то до назви додається суфікс -карбальдегід[4][5].
Якщо в даній сполуці альдегідна група не є старшою, то в таких випадках її позначають використовуючи приставку форміл-, вказуючи її положення[5].
У застарілих Женевській (1892) та Льєжській (1930) номенклатурах, згодом замінених систематичною номенклатурою ІЮПАК, альдегіди позначалися з допомогою суфікса -ал[6].

Альдегіди класифікуються наступним чином (в дужках наведені приклади)[7]:
- В залежності від насиченості вуглеводневого замісника:
- граничні (насичені) альдегіди (ацетальдегід);
- неграничні (ненасичені) альдегіди (акролеїн);
- ароматичні альдегіди (бензальдегід).
- За кількістю карбонільних груп:
- альдегіди з однією карбонільною групою (формальдегід);
- діальдегіди (гліоксаль);
- багатоатомні альдегіди.


Альдегідна група міститься в багатьох природних речовинах, таких, як вуглеводи (альдози), деякі вітаміни (ретиналь, піридоксаль). Їх сліди містяться в ефірних маслах і часто сприяють їх приємному запаху, наприклад, коричний альдегід (в касієвому маслі його може бути до 75 %, а в цейлонському коричному маслі навіть до 90 %) і ванілін.
Аліфатичний альдегід СН3(СН2)7С(Н)=О (тривіальна назва — пеларгоновий альдегід) міститься в ефірних маслах цитрусових рослин, має запах апельсина, його використовують як харчовий ароматизатор[8].
Цитраль міститься в лемонграсовому та коріандровому маслах (до 80 %), цитронелаль — в цитронеловому (близько 30 %) та евкаліптовому, бензальдегід — в маслі гіркого мигдалю. Куміновий альдегід міститься в маслі кмину, геліотропін — в маслі гелітропа і бузку, анісовый альдегід[ru] та жасмінальдегід в невеликих кількостях містяться в багатьох ефірных маслах.[3][2].
- Для отримання альдегідів в лабораторних умовах часто використовується реакція окиснення первинних спиртів реагентами, які є комплексними сполуками оксиду хрому (VI) з третинними амінами, зокрема, найкращими реагентами є комплекс із піридином (CrO3 · 2C5H5N, реагент Саррета — Коллінза) і хлорхромат піридинию[ru] (C5H5N+CrO3Cl-, реагент Корі, PCC). Ці реагенти дозволяють отримувати альдегіди з високим виходом, а хлорхромат піридинию також не чіпає подвійний зв'язок. З цією ж метою застосовуються й інші селективні окисники, наприклад оксид марганцю(IV) MnO2, карбонат срібла[ru] на цеоліті, а також диметилсульфоксид у присутності основи (окиснення за Сверном)[9].
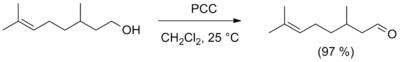
- Як метод отримання альдегідів може використовуватися відновлювальний озоноліз симетричних дизаміщених алкенів або циклічних алкенів (в даному випадку реакція приводить до утворення діальдегіда). Аналогічне перетворення може бути виконане під дією суміші OsO4 і NaIO4[ru][10].

- Також до цього типу реакцій належить окиснення віцинальних діолів йодною кислотою або тетраацетатом свинцю[ru][11].
- Важливим методом також є гідроборування — окиснення алкінів, в ході якого до алкіна проти правила Марковникова приєднується диалкілборан (наприклад, дисіамілборан[ru]), а отриманий продукт окиснюється лужним розчином пероксиду водню, що призводить до утворення альдегіду[12].

Ряд похідних карбонових кислот (хлорангідриди, складні ефіри, нітрили, аміди) можуть бути відновлені до альдегідів під дією специфічних відновників[13].
- Так, наприклад, в реакції Розенмунда[ru] хлорангідриди відновлюють під дією водню на паладієвому каталізаторі. Аналогічні перетворення можна виконати під дією три(трет-бутокси)алюмогідриду літію[14].

- Складні ефіри селективно відновлюються до альдегідів під дією диізобутилалюмінійгідриду[15].
Ароматичні альдегіди можуть бути синтезовані принципово іншими методами, які базуються на реакціях ароматичного електрофільного заміщення.
- Альдегідну групу можна ввести в ароматичні сполуки реакціями Гаттермана, Гаттермана — Коха[ru], Вільсмеєра — Хаака[ru], Ріхе[ru] і Раймера — Тімана. Історично перша реакція Гаттермана — Коха (1897) може бути застосована до бензолу та його алкілзаміщених похідних, які вступають в реакцію з оксидом вуглецю(II) CO та хлороводнем HCl в присутності AlCl3 та CuCl, даючи відповідні бензальдегіди (альдегідна група вводиться в пара-положення). Покращений метод (реакція Гаттермана) полягає у використанні ціаніду цинку[ru] Zn(CN)2 та соляної кислоти і дозволяє формілювати феноли та гетероароматичні сполуки. Для формілювання фенолів також використовується реакція Раймера — Тімана. Введення альдегідної групи в ароматичні ядра, активовані гідроксильною, алкоксильною чи диалкіламінною групою, здійснюється за реакцією Вільсмеєра — Хаака з використанням диметилформаміда і хлорокису фосфору[ru] (або аналогічних реагентів)[16].


- Також ароматичні альдегіди можуть бути одержані окисненням метилзаміщених бензолів під дією ряду окисників, зокрема оксиду хрому(VI) CrO3, оксиду марганцю(IV) MnO2 і нітрату церію — амонію[en][17].
- Реакція Сомле[ru] дозволяє окиснювати бензилгалогеніди ArCH2X під дією уротропіну з подальшим гідролізом утвореної солі до альдегіду. Ця реакція може бути застосована для синтезу різних ароматичних і гетероциклічних альдегідів. Подібне перетворення можна здійснити також окисненням бензилгалогенідів солями 2-нітропропану[17].

- Ароматичні альдегіди можна отримувати з похідних ароматичних карбонових кислот загальними методами, однак існують і специфічні реакції. Наприклад, реакція Стефена дозволяє відновлювати ароматичні нітрили хлоридом олова(II)[ru] SnCl2 з наступним гідролізом, що призводить до утворення ароматичного альдегіду[17].
- ↑ Liebig J. Sur les Produits de l'Oxidation de l'Alcool // Annales de chimie et de physique. — 1835. — Vol. 59. — P. 290.(фр.)
- ↑ а б Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М. : Советская энциклопедия, 1988. — С. 196-198. — 100 000 прим.(рос.)
- ↑ а б Леенсон И. А. Откуда твоё имя? Статья шестая. Органические соединения. Архів оригіналу за 30 червня 2013. Процитовано 25 червня 2013.(рос.)
- ↑ IUPAC Nomenclature of Organic Chemistry (англ.). ACD/Labs. Архів оригіналу за 21 серпня 2011. Процитовано 24 серпня 2009.(англ.)
- ↑ а б Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова, Р. А. Лидина. — М : Химия, 1983. — С. 139—140.(рос.)
- ↑ Справочник химика / Редколлегия: Никольский Б. П. и др. — 2-е издание. — Ленинград, Москва : Химия, 1964. — Т. 2. — С. 270, 285, 295.(рос.)
- ↑ Петров А. А., Бальян Х. В., Трощенко А. Т. Органическая химия. — Иван Федоров, 1981. — Т. 1. — С. 165-184. — ISBN 5-81940-067-4.(рос.)
- ↑ Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. — М. : Химия, 1974.(рос.)
- ↑ Реутов, 2004, с. 265—273, т. 2.
- ↑ Реутов, 2004, с. 12—13, т. 3.
- ↑ Помилка цитування: Неправильний виклик тегу
<ref>: для виносок під назвоюШабаровне вказано текст - ↑ Реутов, 2004, с. 480—483, т. 1.
- ↑ Реутов, 2004, с. 13—14, т. 3.
- ↑ Реутов, 2004, с. 203—205, т. 3.
- ↑ Реутов, 2004, с. 235, т. 3.
- ↑ Марч Дж. Органическая химия. — М. : Мир, 1987. — Т. 2. — С. 359—363.(рос.)
- ↑ а б в Реутов, 2004, с. 16—20, т. 3.

![{\displaystyle {\mathsf {CH_{2}(OH){-}CH_{2}(OH){\xrightarrow[{HIO_{4}}]{}}2CH_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9d6919d90b037d655c0f4715fe8c3855c8c1732)