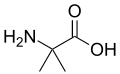
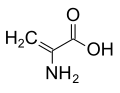
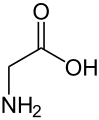
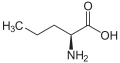
Непротеїногенні амінокислоти

У біохімії некодовані або непротеїногенні амінокислоти відрізняються від 22 протеїногенних амінокислот (21 в еукаріот [1]), які природним чином закодовані в геномі організмів для формування білків. Проте понад 140 непротеїногенних амінокислот зустрічаються в білках природним шляхом, і тисячі інших можуть зустрічатися в природі або синтезуватися в лабораторії. [2] Хімічно синтезовані амінокислоти можна назвати неприродними амінокислотами. Неприродні амінокислоти можуть бути отримані синтетичним шляхом з їхніх нативних аналогів за допомогою модифікацій, таких як алкілування аміном, заміна бічного ланцюга, циклізація подовження структурного зв’язку та ізостерична заміна в амінокислотному скелі. [3] Багато непротеїногенних амінокислот є важливими:
- проміжні продукти біосинтезу,
- у посттрансляційному утворенні білків,
- у фізіологічній ролі (наприклад, компоненти стінок бактеріальних клітин, нейромедіатори та токсини ),
- природні або створені людиною фармакологічні сполуки,
- міститься в метеоритах або використовується в пребіотичних експериментах (таких як експеримент Міллера-Юрі ),
- можуть бути важливими нейромедіаторами, такими як γ-аміномасляна кислота [4] і
- може відігравати вирішальну роль у клітинній біоенергетиці, наприклад креатин . [5]

Технічно будь-яка органічна сполука з функціональною групою аміну (–NH 2 ) і карбонової кислоти (–COOH) є амінокислотою. Протеїногенні амінокислоти є невеликою підмножиною цієї групи, яка має центральний атом вуглецю (α- або 2-), що містить аміногрупу, карбоксильну групу, бічний ланцюг і α-водневу ліву конформацію, за винятком гліцину, який є ахіральний, і пролін, аміногрупа якого є вторинним аміном і, отже, часто згадується як імінокислота з традиційних причин, хоча і не є імінокислотою.
Генетичний код кодує 20 стандартних амінокислот для включення в білки під час трансляції. Однак є дві додаткові протеіногенні амінокислоти: селеноцистеїн і піролізин . Ці нестандартні амінокислоти не мають виділеного кодону, але додаються замість стоп-кодону, коли присутня певна послідовність, кодон UGA та елемент SECIS для селеноцистеїну, [6] послідовність UAG PYLIS для піролізину. [7] Усі інші амінокислоти називаються «непротеїногенними».
-
Селеноцистеїн. Ця амінокислота містить селенольну групу на β-вуглеці
-
Піролізин. Ця амінокислота утворюється шляхом приєднання до ε-аміногрупи лізину карбоксильованого піролінового кілця.
Існують різні групи амінокислот: [8]
- 20 стандартних амінокислот
- 22 протеїногенні амінокислоти
- понад 80 амінокислот, створених абіотично у високих концентраціях
- близько 900 виробляються природними шляхами
- понад 118 сконструйованих амінокислот були введені в білок
Ці групи перетинаються, але не є ідентичними. Усі 22 протеїногенні амінокислоти біосинтезуються організмами, і деякі, але не всі, з них також є абіотичними (виявлені в пребіотичних експериментах і метеоритах). Деякі природні амінокислоти, такі як норлейцин, помилково включаються в білки під час трансляції через порушення процесу синтезу білка. Багато амінокислот, таких як орнітин, є метаболічними проміжними продуктами, що виробляються біосинтетично, але не включені трансляційно в білки. Посттрансляційна модифікація амінокислотних залишків у білках призводить до утворення багатьох білкових, але непротеїногенних амінокислот. Інші амінокислоти містяться виключно в абіотичних сумішах (наприклад, α-метилнорвалін). Більше 30 неприродних амінокислот було включено у білок під час трансляції синтетичним шляхом, але вони не є біосинтетичними. [8]
На додаток до системи нумерації IUPAC для диференціації різних атомів вуглецю в органічній молекулі шляхом послідовного присвоєння номера кожному вуглецю, включаючи ті, що утворюють карбоксильну групу, атоми вуглецю вздовж бічного ланцюга амінокислот також можна позначати грецькими літерами., де α-вуглець є центральним хіральним вуглецем, що має карбоксильну групу, бічний ланцюг і, в α-амінокислотах, аміногрупу – вуглець у карбоксильних групах не враховується. [9] (Отже, назви IUPAC багатьох непротеїногенних α-амінокислот починаються з 2-аміно- і закінчуються на -інова кислота .)
Більшість природних амінокислот є α-амінокислотами в L- конфігурації, але існують деякі винятки.

Деякі не-α-амінокислоти існують в організмах. У цих структурах амінна група зміщується далі від кінця карбонової кислоти молекули амінокислоти. Таким чином, β-амінокислота має аміногрупу, приєднану до другого вуглецю, а γ-амінокислота має її на третьому. Приклади включають β-аланін, ГАМК і δ- амінолевулінову кислоту.
-
β-аланін: амінокислота синтезується аспартат 1-декарбоксилазою та є попередником коензиму А та пептидів карнозину та ансерину.
-
γ-Аміномасляна кислота (GABA, ГАМК): нейромедіаітор у тварин.
-
4-Амінобензойна кислота (PABA, ПАБК): інтермедіат у біосинтезі фолієвої кислоти.
Причина, чому α-амінокислоти використовуються в білках, пов’язана з їх пошиерністю в метеоритах і пребіотичних експериментах. [10] Початкове припущення про шкідливі властивості β-амінокислот з точки зору вторинної структури [10] виявилося невірним. [11]
Деякі амінокислоти містять протилежну абсолютну хіральність, хімічні речовини, які недоступні із звичайних механізмів трансляції та транскрипції. Стінки більшості бактеріальних клітин утворені пептидогліканом, полімером, що складається з аміноцукрів, зшитих короткими олігопептидами, сполученими між собою. Олігопептид не синтезується рибосомами і містить кілька особливостей, включаючи D-амінокислоти, як правило, D -аланін і D -глутамат. Ще одна особливість полягає в тому, що D -аланін рацемізується ферментами, що зв’язують PLP (кодуються alr або гомологом dadX ), тоді як D -глутамат рацемізується незалежним від кофактора ферментом (murI ). Наприклад, D -лізин присутній у Thermotoga spp., а в деяких стійких до ванкоміцину бактеріях присутній D -серин (ген vanT ). [12] [13]
Усі протеїногенні амінокислоти мають принаймні один атом водню на α-вуглеці. Гліцин має два атоми водню, а всі інші мають один атом водню та один бічний ланцюг. Заміна водню, що залишився, більшим замісником, таким як метильна група, спотворює білкову основу. [10]
У деяких грибах α-аміноізомасляна кислота виробляється як попередник пептидів, деякі з яких виявляють антибіотичні властивості. [14] Ця сполука подібна до аланіну, але має додаткову метильну групу на α-вуглеці замість водню. Тому він є ахіральним. Іншою сполукою, подібною до аланіну без α-водню, є дегідроаланін, який має метиленовий бічний ланцюг. Це одна з кількох природних дегідроамінокислот .
-
аміноізомасляна кислота
-
дегідроаланін
Підгрупа L -α-амінокислот неоднозначна щодо того, який із двох кінців є α-вуглецем. У білках залишок цистеїну може утворювати дисульфідний зв’язок з іншим залишком цистеїну, таким чином зшиваючи білок. Два зшиті цистеїни утворюють молекулу цистину . Цистеїн і метіонін зазвичай утворюються шляхом прямого сульфурилювання, але в деяких видів вони можуть бути отримані шляхом транссульфурування, коли активований гомосерин або серин зливається з цистеїном або гомоцистеїном, утворюючи цистатіонін . Подібною сполукою є лантіонін, який можна розглядати як дві молекули аланіну, з’єднані тіоефірним зв’язком, який зустрічається в різних організмах. Подібним чином дженколієва кислота, рослинний токсин із бобів Дженгколь, складається з двох цистеїнів, з’єднаних метиленовою групою. Діамінопімелінова кислота використовується як місток у пептидоглікані та використовується як попередник лізину (через його декарбоксилювання).
Пребіотичні амінокислоти та альтернативна біохімія
[ред. | ред. код]У метеоритах і в пребіотичних експериментах (наприклад, в експерименті Міллера-Юрі ) виявлено набагато більше амінокислот, ніж двадцять стандартних амінокислот, деякі з яких містяться у вищих концентраціях, ніж стандартні. Було припущення, що якби амінокислотне життя виникло десь у Всесвіті, то не більше 75% амінокислот були б спільними. [10] Найбільш помітною аномалією є відсутність аміномасляної кислоти.
| Сполука | Електричний заряд | Мерчисонський метеорит |
|---|---|---|
| гліцин | 100 | 100 |
| аланін | 180 | 36 |
| α-аміно-n-масляна кислота | 61 | 19 |
| норвалін | 14 | 14 |
| валін | 4.4 | |
| норлейцин | 1.4 | |
| лейцин | 2.6 | |
| ізолейцин | 1.1 | |
| алоізолейцин | 1.2 | |
| t-лейцин | < 0.005 | |
| α-аміно-n-енантова кислота | 0.3 | |
| пролін | 0.3 | 22 |
| піпеколієва кислота | 0.01 | 11 |
| α,β-діамінопропіонова кислота | 1.5 | |
| α,γ-діаміномасляна кислота | 7.6 | |
| орнітин | < 0.01 | |
| лізин | < 0.01 | |
| аспарагінова кислота | 7.7 | 13 |
| глутамінова кислота | 1.7 | 20 |
| серин | 1.1 | |
| треонін | 0.2 | |
| алотреонін | 0.2 | |
| метіонін | 0.1 | |
| гомоцистеїн | 0.5 | |
| гомосерин | 0.5 | |
| β-аланін | 4.3 | 10 |
| β-аміно-n-масляна кислота | 0.1 | 5 |
| β-аміноізомасляна кислота | 0.5 | 7 |
| γ-аміномасляна кислота | 0.5 | 7 |
| α-аміноізомасляна кислота | 7 | 33 |
| ізовалін | 1 | 11 |
| саркозин | 12.5 | 7 |
| N-етилгліцин | 6.8 | 6 |
| N-пропілгліцин | 0.5 | |
| N-ізопропілгліцин | 0.5 | |
| N-метилаланін | 3.4 | 3 |
| N-етилаланін | < 0.05 | |
| N-метил-β-аланін | 1.0 | |
| N-етил-β-аланін | < 0.05 | |
| iзосерин | 1.2 | |
| α-гідрокси-γ-аміномасляна кислота | 17 |
Генетичний код був описаний як заморожена випадковість, і причиною, чому існує лише одна стандартна амінокислота з прямим ланцюгом, аланін, може бути просто надлишок валіну, лейцину та ізолейцину. [10] Однак, вважається, що амінокислоти з прямим ланцюгом утворюють набагато більш стабільні альфа-спіралі. [15]
-
гліцин (бічний ланцюг водню)
-
аланін (метил бічний ланцюг)
-
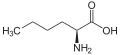
гомоаланін, або α-аміномасляна кислота (етиловий бічний ланцюг)
-
норвалін (бічний ланцюг н-пропілу)
-
норлейцин (бічний ланцюг н-бутилу)
-
гомонорлейцин (бічний ланцюг п-пентилу, показана гептанова кислота)
Серин, гомосерин, O-метилгомосерин і O-етилгомосерин мають гідроксиметильний, гідроксиетиловий, O-метилгідроксиметильний і O-метилгідроксиетильний бічний ланцюг; тоді як цистеїн, гомоцистеїн, метіонін і етіонін мають тіолові еквіваленти. Еквівалентами селенолу є селеноцистеїн, селеногомоцистеїн, селенометіонін і селеноетіонін. Амінокислоти з наступним зниженням халькогену також зустрічаються в природі: кілька видів, таких як Aspergillus fumigatus, Aspergillus terreus і Penicillium chrysogenum, за відсутності сірки здатні продукувати та включати в білок телуроцистеїн і телурометіонін. [16]
У клітинах, особливо автотрофних, кілька непротеїногенних амінокислот зустрічаються як метаболічні проміжні продукти. Однак, незважаючи на каталітичну гнучкість PLP-зв'язуючих ферментів, багато амінокислот синтезуються як кетокислоти (наприклад, 4-метил-2-оксопентаноат до лейцину) і амінуються на останньому етапі, таким чином зберігаючи рівень непротеїногенних амінокислот у ролі проміжних продуктів досить низьким.
Орнітин і цитрулін беруть участь у циклі сечовини, що є частиною катаболізму амінокислот. [17]
На додаток до первинного метаболізму, кілька непротеїногенних амінокислот є попередниками або кінцевим продуктом у вторинному метаболізмі для створення невеликих сполук або нерибосомних пептидів (таких як деякі токсини).
Незважаючи на те, що вони не кодуються генетичним кодом як протеїногенні амінокислоти, деякі нестандартні амінокислоти все ж містяться в білках. Вони утворюються шляхом посттрансляційної модифікації бічних ланцюгів стандартних амінокислот, присутніх у цільовому білку. Ці модифікації часто необхідні для функціонування або регуляції білка; наприклад, в γ-карбоксиглутаматі карбоксилювання глутамату забезпечує краще зв'язування катіонів кальцію [18], а в гідроксипроліні гідроксилювання проліну є критичним для підтримки сполучних тканин . [19] Іншим прикладом є утворення гіпузину у факторі ініціації трансляції EIF5A шляхом модифікації залишку лізину. [20] Такі модифікації також можуть визначати локалізацію білка, наприклад, додавання довгих гідрофобних груп може призвести до зв’язування білка з фосфоліпідною мембраною. [21]
-
Карбоксиглутамінова кислота. Тоді як глутамінова кислота має одну γ-карбоксильну групу, карбоксиглутамінова кислота має дві.
-
Гідроксипролін. Ця амінокислота відрізняється від проліну гідроксильною групою при 4 вуглеці.
-
Гіпузин. Ця амінокислота отримується шляхом додавання до ε-аміногрупи лізину 4-амінобутилового фрагмента (отриманого зіспермідину)
-
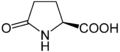
Піроглутамінова кислота
Існують деякі попередні докази того, що аміномалонова кислота може бути присутня в білку, можливо, через неправильне включення. [22] [23]
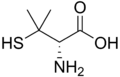
Кілька непротеїногенних амінокислот є токсичними через їх здатність імітувати певні властивості протеїногенних амінокислот, таких як тіалізин . Деякі непротеїногенні амінокислоти є нейротоксичними, імітуючи амінокислоти, які використовуються як нейротрансмітери (тобто не для біосинтезу білка), включаючи квісквалінову кислоту, канаванін і азетидин-2-карбонову кислоту. [24] Цефалоспорин С має основу α-аміноадипінової кислоти (гомоглутамат), яка амідована цефалоспориновим фрагментом. [25] Пеніциламін є терапевтичною амінокислотою, механізм дії якої невідомий.
-
Тіалізин
-
Квісквалова кислота
-
Канаванін
-
Азетидин-2-карбонова кислота
-
Цефалоспорин С
-
Пеніциламін
Ціанотоксини, що зустрічаються в природі, також можуть включати непротеїногенні амінокислоти. Мікроцистин і нодулярін, наприклад, походять від ADDA, β-амінокислоти.
Таурин є аміносульфоновою кислотою, а не амінокарбоновою кислотою, однак іноді її вважають такою, оскільки кількості, необхідні для пригнічення ауксотрофу в певних організмах (таких як коти), ближчі до кількості «незамінних амінокислот» (ауксотрофія амінокислот), ніж у вітамінів (кофакторна ауксотрофія).
Осмоліти, саркозин і гліцинбетаїн є похідними амінокислот, але мають вторинний і четвертинний амін відповідно.
- ↑ плюс формілметіонін в еукаріотах з прокаріотними органелами, такими як мітохондрії
- ↑ Ambrogelly, A.; Palioura, S.; Söll, D. (2007). Natural expansion of the genetic code. Nature Chemical Biology. 3 (1): 29—35. doi:10.1038/nchembio847. PMID 17173027.
- ↑ Avan, Ilker; Hall, C. Dennis; Katritzky, Alan R. (22 квітня 2014). Peptidomimetics via modifications of amino acids and peptide bonds. Chemical Society Reviews. 43 (10): 3575—3594. doi:10.1039/C3CS60384A. PMID 24626261.
- ↑ Sarasa, Sabna B.; Mahendran, Ramasamy; Muthusamy, Gayathri; Thankappan, Bency; Selta, Daniel Raja Femil; Angayarkanni, Jayaraman (2020). A Brief Review on the Non-protein Amino Acid, Gamma-amino Butyric Acid (GABA): Its Production and Role in Microbes. Current Microbiology. 77 (4): 534—544. doi:10.1007/s00284-019-01839-w. PMID 31844936.
- ↑ Ostojic, Sergej M. (1 серпня 2021). Creatine as a food supplement for the general population. Journal of Functional Foods. 83: 104568. doi:10.1016/j.jff.2021.104568. ISSN 1756-4646.
- ↑ Böck, A.; Forchhammer, K.; Heider, J.; Baron, C. (1991). Selenoprotein synthesis: An expansion of the genetic code. Trends in Biochemical Sciences. 16 (12): 463—467. doi:10.1016/0968-0004(91)90180-4. PMID 1838215.
- ↑ Théobald-Dietrich, A.; Giegé, R.; Rudinger-Thirion, J. L. (2005). Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins. Biochimie. 87 (9–10): 813—817. doi:10.1016/j.biochi.2005.03.006. PMID 16164991.
- ↑ а б Lu, Y.; Freeland, S. (2006). On the evolution of the standard amino-acid alphabet. Genome Biology. 7 (1): 102. doi:10.1186/gb-2006-7-1-102. PMC 1431706. PMID 16515719.
- ↑ Voet, D.; Voet, J. G. (2004). Biochemistry (вид. 3rd). John Wiley & Sons. ISBN 978-0471193500.
- ↑ а б в г д Weber, A. L.; Miller, S. L. (1981). Reasons for the occurrence of the twenty coded protein amino acids. Journal of Molecular Evolution. 17 (5): 273—284. Bibcode:1981JMolE..17..273W. doi:10.1007/BF01795749. PMID 7277510.
- ↑ Koyack, M. J.; Cheng, R. P. (2006). Design and Synthesis of β-Peptides With Biological Activity. Protein Design. Methods in Molecular Biology. Т. 340. с. 95—109. doi:10.1385/1-59745-116-9:95. ISBN 978-1-59745-116-1. PMID 16957334.
- ↑ Boniface, A.; Parquet, C.; Arthur, M.; Mengin-Lecreulx, D.; Blanot, D. (2009). The Elucidation of the Structure of Thermotoga maritima Peptidoglycan Reveals Two Novel Types of Cross-link. Journal of Biological Chemistry. 284 (33): 21856—21862. doi:10.1074/jbc.M109.034363. PMC 2755910. PMID 19542229.
- ↑ Arias, C. A.; Martín-Martínez, M.; Blundell, T. L.; Arthur, M.; Courvalin, P.; Reynolds, P. E. (1999). Characterization and modelling of vanT: A novel, membrane-bound, serine racemase from vancomycin-resistant Enterococcus gallinarum BM4174. Molecular Microbiology. 31 (6): 1653—1664. doi:10.1046/j.1365-2958.1999.01294.x. PMID 10209740.
- ↑ Gao, X.; Chooi, Y. H.; Ames, B. D.; Wang, P.; Walsh, C. T.; Tang, Y. (2011). Fungal Indole Alkaloid Biosynthesis: Genetic and Biochemical Investigation of the Tryptoquialanine Pathway in Penicillium aethiopicum. Journal of the American Chemical Society. 133 (8): 2729—2741. doi:10.1021/ja1101085. PMC 3045477. PMID 21299212.
- ↑ Padmanabhan, S.; Baldwin, R. L. (1991). Straight-chain non-polar amino acids are good helix-formers in water. Journal of Molecular Biology. 219 (2): 135—137. doi:10.1016/0022-2836(91)90553-I. PMID 2038048.
- ↑ Ramadan, S. E.; Razak, A. A.; Ragab, A. M.; El-Meleigy, M. (1989). Incorporation of tellurium into amino acids and proteins in a tellurium-tolerant fungi. Biological Trace Element Research. 20 (3): 225—232. doi:10.1007/BF02917437. PMID 2484755.
- ↑ Curis, E.; Nicolis, I.; Moinard, C.; Osowska, S.; Zerrouk, N.; Bénazeth, S.; Cynober, L. (2005). Almost all about citrulline in mammals. Amino Acids. 29 (3): 177—205. doi:10.1007/s00726-005-0235-4. PMID 16082501.
- ↑ Vermeer, C. (1990). Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase. The Biochemical Journal. 266 (3): 625—636. doi:10.1042/bj2660625. PMC 1131186. PMID 2183788.
- ↑ Bhattacharjee, A; Bansal, M (2005). Collagen structure: The Madras triple helix and the current scenario. IUBMB Life. 57 (3): 161—172. doi:10.1080/15216540500090710. PMID 16036578.
- ↑ Park, M. H. (2006). The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A). Journal of Biochemistry. 139 (2): 161—169. doi:10.1093/jb/mvj034. PMC 2494880. PMID 16452303.
- ↑ Blenis, J; Resh, M. D. (1993). Subcellular localization specified by protein acylation and phosphorylation. Current Opinion in Cell Biology. 5 (6): 984—989. doi:10.1016/0955-0674(93)90081-z. PMID 8129952.
- ↑ Copley, S. D.; Frank, E.; Kirsch, W. M.; Koch, T. H. (1992). Detection and possible origins of aminomalonic acid in protein hydrolysates. Analytical Biochemistry. 201 (1): 152—157. doi:10.1016/0003-2697(92)90188-D. PMID 1621954.
- ↑ Van Buskirk, J. J.; Kirsch, W. M.; Kleyer, D. L.; Barkley, R. M.; Koch, T. H. (1984). Aminomalonic acid: Identification in Escherichia coli and atherosclerotic plaque. Proceedings of the National Academy of Sciences. 81 (3): 722—725. Bibcode:1984PNAS...81..722V. doi:10.1073/pnas.81.3.722. PMC 344907. PMID 6366787.
- ↑ Dasuri, K.; Ebenezer, P. J.; Uranga, R. M.; Gavilán, E.; Zhang, L.; Fernandez-Kim, S. O. K.; Bruce-Keller, A. J.; Keller, J. N. (2011). Amino acid analog toxicity in primary rat neuronal and astrocyte cultures: Implications for protein misfolding and TDP-43 regulation. Journal of Neuroscience Research. 89 (9): 1471—1477. doi:10.1002/jnr.22677. PMC 3175609. PMID 21608013.
- ↑ Trown, P. W.; Smith, B.; Abraham, E. P. (1963). Biosynthesis of cephalosporin C from amino acids. The Biochemical Journal. 86 (2): 284—291. doi:10.1042/bj0860284. PMC 1201751. PMID 13994319.