Обговорення:Хронічне обструктивне захворювання легень
Додати тему| Стаття «Хронічне обструктивне захворювання легень» входить до спільного для всіх мовних розділів Вікіпедії списку необхідних статей. Її покращення й доведення до статусу вибраної є важливим напрямком роботи проєкту. |
Більше контенту
[ред. код]Більше контенту ви можете додати з EN Wikpedia, переклад перекладачів без кордонів.
<!-Визначення і симптоми -> Хронічне обструктивне захворювання легень (ХОЗЛ), також відоме як хронічна обструктивна хвороба легень (ХОХЛ), і хронічна обструктивна хвороба дихальних шляхів (ХОХДШ), зокрема, є одним з видів обструктивної хвороби легень, що характеризується хронічним недостатнім проходженням повітря. -> Цей стан, як правило, погіршується з плином часу. Основні симптоми включають задишку, кашель і появу [[мокротиння].[1] Більшість людей із хронічним бронхітом страждають на ХОЗЛ.[2]
<!-Причина та діагностика-> Тютюнопаління є найбільш частою причиною ХОЗЛ, наряду з іншими факторами, такими як забруднення повітря і генетика, що відіграють меншу роль.[3] В країнах, що розвиваються, одними із найбільш поширених джерел забруднення повітря є недостатня вентиляція відкритого вогню, що використовується для приготування їжі та опалення. Тривала дія цих подразників викликає запальну реакцію в легенях, що призводить до звуження дрібних дихальних шляхах і розпаду легеневої тканини, що називається емфізема.[4] Діагноз грунтується на недостатньому проходженні повітряного потоку, який оцінюється за допомогою дослідження функції легень.[5] На відміну від астми, зниження повітряного потоку не можна суттєво поліпшити прийомом ліків.
ХОЗЛ може бути попереджено шляхом зменшення впливу відомих причин. Це включає в себе заходи із зниження показників паління й поліпшення якості повітря в приміщенні і на відкритому повітрі. Лікування ХОЗЛ включають: відмова від паління, вакцинації, реабілітацію, і часто інгаляційні бронхолітичні засоби та стероїди. Дехто може отримати користь від довгострокової кисневої терапії або трансплантації легенів.[4] Для хворих, у яких бувають періоди різкого погіршення, може знадобитися більш широке використання ліків і госпіталізації.
У всьому світі на ХОЗЛ хворіє 329 мільйонів чоловік, або близько 5% населення. У 2012 році вона була третьою за значимістю причиною смерті, яка призвела до смерті більше 3 мільйонів людей .[6] Число померлих, за прогнозами, збільшиться за рахунок більш високих рівнів куріння і старіння населення в багатьох країнах.[7] Це призвело до оцінок економічної витрат у розмірі 2,1 трлн доларів США у 2010 році.[8]
Ознаки та симптоми
[ред. код]Найбільш поширеними симптомами ХОЗЛ є виділення мокротиння, задишка і продуктивний кашель.[9] Ці симптоми присутні протягом тривалого періоду часу[2] і, як правило, погіршуються із плином часу.[4] Неясно, чи існують різні види ХОЗЛ.[3] У той час, як її раніше поділяли на емфізему і хронічний бронхіт, емфізема — це тільки опис змін у легенях, а не сама хвороба, а хронічний бронхіт —просто дескриптор симптомів, які можуть трапитися, а можуть і не трапитися при ХОЗЛ.[1]
Кашель
[ред. код]Хронічний кашель є, як правило, першим симптомом, що виникає. Коли він триває більше трьох місяців на рік протягом більше двох років, в поєднанні з виділенням мокроти і без іншого пояснення, це є за визначенням хронічного бронхіту. Ця патологія може виникнути до того, як ХОЗЛ повністю розвинеться. Кількість виробленого мокротиння може змінюватися час від часу. У деяких випадках кашель може бути відсутнім або виникає лише зрідка і може бути непродуктивним. Деякі хворі на ХОЗЛ пов'язують симптоми з "кашлем курця". Мокротиння проковтують або спльовують, зазвичай залежно від соціальних і культурних чинників. Енергійний кашель може привести до перелому ребер або короткочасної втрати свідомості. У хворих на ХОЗЛ часто в анамнезі є "застуда", що тривала довгий час.[9]
Задишка
[ред. код]Задишка часто є симптомом, який найбільше турбує людей.[10] Вона зазвичай описується як "утруднене дихання", "задишка" або "неможливість отримати достатньо повітря".[11] Різні терміни, однак, можуть використовуватися в різних культурах. [9] Зазвичай задишка погіршується при фізичному навантаженні, триває довше і погіршується з плином часу. [9] На пізніх стадіях вона трапляється під час відпочинку і може бути завжди присутньою.[12][13] Вона викликає як тривожність, так і низьку якість життя у хворих на ХОЗЛ.[9] Багато людей з більш пізньою стадією ХОЗЛ дихають через стиснуті губи, і це може полегшити задишку у деяких хворих.[14][15]
Інші особливості
[ред. код]При ХОЗЛ видихання може зайняти більше часу, ніж вдихання.[16] Може відчуватися біль у грудях,[9] але це трапляється нечасто і може бути викликане іншою проблемою.[10] У хворих із утрудненим проходженням повітряного потоку можуть бути хрипи або приглушений вхід повітря під час обстеження грудної клітини за допомогою стетоскопу.[16] Бочкоподібна грудна клітка є характерною ознакою ХОЗЛ, але зустрічається порівняно рідко.[16] Поза триножника може виникати у міру розвитку хвороби. [2]
ХОЗЛ на пізній стадії призводить до високого тиску на артерії легенів, що напружує правий шлуночок серця.[4][17][18] Ця ситуація називається легеневе серце, і призводить до таких симптомів, як набряки ніг[9] і вирячені вени шиї.[4] ХОЗЛ є більш поширеною причиною легеневого серця, ніж будь-яка інша хвороба легенів.[17] Легеневе серце з’являється дедалі рідше після того, як почалося використання додаткового кисню.[2]
ХОЗЛ часто трапляється разом із рядом інших патологій, з якими вона частково поділяє фактори ризику.[3] Ці патології включають в себе: ішемічну хворобу серця, високий кров'яний тиск, цукровий діабет, втрату м'язової маси, остеопороз, рак легенів, тривожний розлад і депресію.[3] В людей з важкою формою захворювання часто виникає постійне відчуття втоми. [9] симптом барабанних паличок не є специфічним для ХОЗЛ, і його наявність має змусити провести обстеження на предмет раку легенів.[19]
Загострення
[ред. код]Загострення ХОЗЛ визначається за збільшенням задишки, збільшенням кількості мокротиння, зміною кольору мокротиння з прозорого на зелений або жовтий, або погіршення кашлю у хворих на ХОЗЛ.[16] Це загострення може проявлятися у вигляді таких симптомів: пришвидшене дихання, наприклад прискорене дихання, прискорений ритм серця, пітливість, активне використання шийних м'язів, посиніння шкіри, і сплутаність мислення або агресивна поведінка при дуже важкому загостренні.[16][20] Вологі хрипи також можна почути у легенях при обстеженні зі стетоскопом.[21]
Причина
[ред. код]Основною причиною розвитку ХОЗЛ є тютюновий дим; в деяких країнах її викликають професійні впливи і забруднення від відкритого вогню в приміщеннях.[1] Як правило, ці впливи повинні діяти протягом декількох десятиліть до появи симптомів.[1] Генетика людини також впливає на ризик.[1]
Паління
[ред. код]Основним фактором ризику розвитку ХОЗЛ у всьому світі є паління тютюну.[1] З тих, хто палить, близько 20% страждають на ХОЗЛ,[23] а з тих, хто все життя палив, близько половини страждають на ХОЗЛ.[24] У США і Великобританії серед хворих на ХОЗЛ 80-95% є або активними курцями або раніше курили.[23][25][26] Вірогідність розвитку ХОЗЛ збільшується із кількістю викурених цигарок.[27] Крім того, жінки більш сприйнятливі до шкідливого впливу диму, ніж чоловіки.[26] У некурящих пасивне куріння є причиною близько 20% випадків.[25] Інші види з диму, наприклад марихуана, сигари і пар, також становлять небезпеку.[1] Жінки, які курять під час вагітності, можуть збільшити ризик ХОЗЛ у своєї дитини.[1]
Забруднення повітря
[ред. код]Погана вентиляція при приготуванні їжі на відкритому вогню, часто на вугіллі або біопаливі, як-от дерево і гній, призводить до забруднення повітря всередині приміщень і є однією з найбільш поширених причин ХОЗЛ в країнах, що розвиваються.[28] Відкритий вогонь використовують для приготування їжі та опалення майже 3 мільярди людей, серед них більшої шкоди здоров'я зазнають жінки у зв'язку з більшим впливом.[1][28] Відкритий вогонь використовується в якості основного джерела енергії в 80% будинків в Індії, Китаї та в африканських країнах на південь від Сахари.[29]
Люди, які живуть у великих містах, мають вищий рівень ХОЗЛ в порівнянні з людьми, які живуть у сільській місцевості.[30] Хоча міське забруднення повітря є чинником, що сприяє загостренням, його загальна роль в якості причини ХОЗЛ неясна. [1] Райони з поганою якістю атмосферного повітря, в тому числі, через вихлопні гази, як правило, мають більш високі показники ХОЗЛ.[29] Загальний ефект у порівнянні з палінням, однак, є невеликим, за оцінками.[1]
Професійний вплив
[ред. код]Інтенсивний і тривалий вплив на робочих місцях пилу, хімічних речовин і газів збільшує ризик виникнення ХОЗЛ у курящих і некурящих.[31] Вплив на робочому місці, як вважають, є причиною в 10-20% випадків.[32] У Сполучених Штатах вважають, що цей чинник пов'язаний з більш ніж 30% випадків серед тих, хто ніколи не палив і, ймовірно, представляє більший ризик в країнах без належних нормативів у сфері охорони праці.[1]
Ряд підприємств і джерел були причетні, в тому числі[29], до сильного запилення у таких галузях, як видобуток вугілля, видобуток золота, і текстильно-бавовняна промисловість, професіях, пов'язаним із використанням кадмію, ізоцианатів, і димом від зварювання.[31] Робота в сільському господарстві також пов’язана із ризиком.[29] В деяких професіях ризики були оцінені як еквівалентна від півтора до двох пачок сигарет на день.[33] Влив пилу кремнію може також привести до ХОЗЛ, при цьому ризик не пов'язаний із ризиком виникнення силікозу.[34] Негативні наслідки впливу пилу і впливу сигаретного диму можуть накопичуватися і навіть більше, ніж накопичуватися.[33]
Генетика
[ред. код]Генетика відіграє певну роль у розвитку ХОЗЛ.[1] Ця хвороба частіше зустрічається серед родичів хворих на ХОЗЛ, які курять, ніж серед курців, що не є родичами.[1] На даний час існує лише один явно успадкований фактор ризику — це дефіцит альфа-1-антитрипсину (AAT).[35] Цей ризик особливо високий у випадку, якщо людина з дефіцитом альфа-1-антитрипсину також курить.[35] Це є причиною близько 1-5% випадків захворювання[35][36], і ця хвороба також виникає приблизно у 3-4 чоловік на 10 000.[2] Досліджуються також інші генетичні фактори,[35] яких, ймовірно, буде багато.[29]
Інші
[ред. код]Ряд інших факторів менш тісно пов'язаний із ХОЗЛ. Ризик зростає у бідних, хоча не ясно, чи це пов'язано з бідністю як такою, чи з іншими факторами ризику, пов'язаними з бідністю, такими як забруднення повітря і недоїдання.[1] Існують попередні докази того, що хворі на астму і гиперреактивність дихальних шляхів підпадають під вищий ризик ХОЗЛ.[1] Чинники народження, такі як низька вага при народженні, можуть також грати певну роль, як і ряд інфекційних захворювань, включаючи ВІЛ/СНІД і туберкульоз. [1] Респіраторні інфекції, наприклад, пневмонія, вірогідно, не збільшують ризик ХОЗЛ, принаймні, у дорослих.[2]
Загострення
[ред. код]Загострення (раптове погіршення симптомів)[37] зазвичай викликані інфекцією або забруднювачами навколишнього середовища, а іноді й іншими чинниками, такими як неправильне використання медичних препаратів.[38] Інфекції, вочевидь, є причиною від 50 до 75% випадків захворювання,[38][39] при цьому на бактерії припадає 25% випадків, на віруси - 25%, а разом вони викликають 25% випадків.[40] Забруднювачі навколишнього середовища включають погану якість повітря як у приміщенні, так і на відкритому повітрі.[38] Вплив диму від активного і пасивного паління підвищує ризик.[29] Холодна температура може також відігравати певну роль: загострення хвороби відбуваються частіше в зимовий час.[41] Хворі з більш тяжким основним захворюванням мають більш часті загострення: при легкій формі захворювання - 1,8 на рік, при помірній формі – від 2 до 3 раз на рік, і при важкій формі 3,4 рази на рік.[42] Хворі із багатьма загостреннями мають більшу швидкість погіршення функції легенів.[43] Легенева емболія (згустки крові в легенях) може погіршити симптоми у пацієнтів з вже існуючою ХОЗЛ.[3]
Патофізіологія
[ред. код]
ХОЗЛ є одним із видів обструктивної хвороби легень, при якій мають місце хронічний неповністю оборотний недостатній потік повітря (обмеження швидкості повітряного потоку) і неможливість видихнути повністю (затримка повітря).[3] Недостатній потік повітря є результатом пробою легеневої тканини (відомий як емфізема) і захворювання малих дихальних шляхів, відоме як обструктивний бронхіоліт. Розмір внеску у захворювання цих двох факторів різняться у різних людей.[1] Тяжке пошкодження малих дихальних шляхів може привести до утворення великих повітряних кишень, відомих як булли, що замінюють легеневу тканину. Ця форма захворювання називається бульозною емфіземою.[44]

ХОЗЛ розвивається як значна і хронічна запальна реакція на інгаляційні подразники.[1] Хронічні бактеріальні інфекції можуть також погіршити цей запальний стан. [43] Задіяні запальні клітини включають нейтрофільні гранулоцити и і з макрофаги, два типи білих кров'яних клітин. У курців додатково задіяні Т-клітини - лімфоцити, а у деяких хворих на ХОЗЛ еозинофіли задіяні так само, як при астмі. Частково такий клітинний відгук викликають медіатори запалення, такі як хемотаксичні фактори. Інші процеси, пов'язані з ураженням легень, включають окислювальний стрес, викликаний високими концентраціями вільних радикалів в тютюновому димі, що виробляються запальними клітинами, і пробоєм сполучної тканини легеньпротеазами, що недостатньо інгібуются інгібіторами протеази. Руйнування сполучної тканини легень призводить до емфіземи, яка в свою чергу сприяє недостатньому повітряному потоку і, нарешті, недостатній абсорбції і виходу дихальних газів.[1] Загальна атрофія м'язів, що часто відбувається при ХОЗЛ, може бути частково обумовлена медіаторами запалення, що їх легені виділяють у кров.[1]
Звуження дихальних шляхів відбувається через запалення і рубцювання всередині них. Це викликає неможливість видихнути повністю. Найбільше зменшення повітряного потоку відбувається при видиханні, коли тиск у грудях давить на дихальні шляхи.[45] Це може привести до того, що більше повітря з попереднього подиху залишається в легенях під час наступного подиху, що призводить до збільшення загального обсягу повітря в легені в будь-який момент часу, процес, що називається гіпервентиляція або захоплення повітря.[45][46] Гіпервентиляція під час фізичних вправ пов'язана з задишкою при ХОЗЛ, оскільки вдихання, коли легені вже частково наповнені, викликає дискомфорт.[47]
У деяких хворих є також певною мірою гіперчутливість дихальних шляхів на подразники, подібні тим, що мають місце при астмі.[2]
Низький рівень кисню і, в кінцевому рахунку, високий рівень вуглекислого газу в крові може статися через поганий газообмін за рахунок недостатньої вентиляції через обструкцію дихальних шляхів, гіпервентиляцію і зменшене бажання дихати.[1] Під час загострень, запалення дихальних шляхів також збільшується, що призводить до збільшення гіпервентиляції, зменшення видиху повітря і погіршення газообміну. Це також може привести до недостатньої вентиляції і, в кінцевому рахунку, до низького рівню кисню в крові.[4] Низький рівень кисню, якщо він присутній протягом тривалого періоду, може привести дозвуження артерій в легенях , в той час як емфізема призводить до руйнування капілярів у легенях. Обидві ці зміни призводять до підвищення артеріального тиску в легеневій артерії, що може викликати появу легеневого серця.[1]
Діагностика
[ред. код]
Діагноз ХОЗЛ слід розглядати в осіб віком від 35 до 40 років, в яких має місце задишка, хронічний кашель, виділення мокротиння або часта зимова застуда і вплив факторів ризику для хвороби в анамнезі.[9][10] Спірометрія потім використовується для підтвердження діагнозу.[9][48]name=Qas2011/>
Спірометрія
[ред. код]Спірометрія вимірює ступінь наявної обструкції й, як правило, здійснюється після використання бронходилататора, - ліків для відкриття дихальних шляхів.[48] Дві основні складові вимірюються для вироблення діагнозу: обсяг форсованого видиху за одну секунду (FEV1), що є найбільшим об'ємом повітря, який людина може видихнути в першу секунду дихання, і форсована життєва ємкість (FVC), яка представляє собою найбільший об'єм повітря, що його людина може видихнути за один великий видих.[49] При нормальному диханні 75-80% FVC виходить у першу секунду [49] і співвідношення FEV1/FVC менш ніж на 70% у хворого з симптомами ХОЗЛ вказує, що ця людина має це захворювання.[48] На основі цих вимірів, спірометрія може призвести до надмірної діагностики ХОЗЛ у літніх людей.[48] Національний інститут якості клінічного обслуговування встановив додаткові критерії, за якими FEV1 має бути менше 80% від належного.[10]
Докази використання спірометрії серед пацієнтів без симптомів задля профілактичного діагностування викликає сумнів, і тому на даний час не рекомендується.[9][48] Максимальна швидкість видиху, показник, що часто використовується при астмі, не є достатнім для діагностики ХОЗЛ.[10]
Тяжкість
[ред. код]| Ступінь | На що впливає |
|---|---|
| 1 | Тільки активна фізична діяльність |
| 2 | Енергійна ходьба |
| 3 | Звичайна ходьба |
| 4 | Після декількох хвилин ходьби |
| 5 | Під час перевдягання |
| Тяжкість | FEV1 % від передбачуваної |
|---|---|
| Незначна (GOLD 1) | ≥80 |
| Помірна (GOLD 2) | 50–79 |
| Тяжка (GOLD 3) | 30–49 |
| Дуже тяжка (GOLD 4) | <30 або хронічна дихальна недостатність |
Для визначення того, як ХОЗЛ впливає на ту чи іншу людину, існує декілька методів.[9] Модифікований опитувальний Британської ради медичних досліджень (mMRC) або тест оцінювання ХОЗЛ (CAT) є простими опитуваннями, що можуть використовуватися для визначення важкості симптомів.[9] Результати за САТ обраховуються за шкалою від 0 до 40; чим вищий результат, тим тяжчий ступінь захворювання.[50] Спірометрія може допомогти визначити серйозність обмеження повітряного потоку.[9] Зазвичай вона базується на FEV1, що є відсотком від передбачуваної норми для особи того самого віку, статі, зросту і ваги.[9] Як американські, так і європейські настанови рекомендують частково базувати рекомендації до лікування на результатах FEV1.[48] Настанови GOLD пропонують розподіляти людей на чотири категорії, залежно від оцінки симптомів та обмеження повітряного потоку.[9] Слід також брати до уваги втрату ваги, слабкість м’язів та наявність інших захворювань. ref name=GOLD2013Chp2/>
Інши види тестування
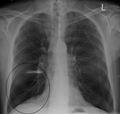
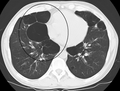
[ред. код]Рентгеноскопія грудної клітини та повний аналіз крові можуть стати в нагоді, щоб виключити інші хвороби під час діагностики.[51] Характерними ознаками ХОЗЛ на рентгенівському зображенні є надто розширені легені, сплощена діафрагма, збільшений загрудинний повітряний простір, а також пухирці, що допомагають виключити інші хвороби легень, такі як пневмонія, набряк легень та пневмоторакс.[52] Відскановане зображення високої роздільної здатності, отримане за допомогою комп’ютерної томографії, може показати розповсюдження емфіземи по легенях, а також допоможе виключити інші хвороби легень.[2] Та крім випадків, коли планується хірургічне втручання, ці результати рідко впливають на догляд за пацієнтом.[2] Газовий аналіз артеріальної крові використовується для визначення потреби в кисні; він рекомендується для пацієнтів із FEV1 менше, ніж 35% від передбачуваного, пацієнтів із периферійним кисневим насиченням менше 92%, а також із симптомами застійної серцевої недостатності.[9] У тих країнах, де розповсюдженим є дефіцит альфа-1 антитріпсину, слід перевірити його рівень у пацієнтах із ХОЗЛ (особливо віком до 45 років та з емфіземою, що ушкодила нижні частини легень).[9]
-
Рентгенівське зображення грудної клітини, що демонструє тяжку ступінь ХОЗЛ.
-
Латеральна рентгеноскопія пацієнта з емфіземою. Зверніть увагу на бочкоподібні груди та пласку діафрагму.
-
Легеневі пухирці на рентгенівському зображенні пацієнта з тяжким ХОЗЛ
-
Тяжкий випадок пухирцевої емфіземи
-
Осьове КТ-зображення легені пацієнта з пухирцевою емфіземою в термінальній стадії.
Диференційна діагностика
[ред. код]ХОЗЛ слід відрізняти від інших причин задишки, таких як застійна серцева недостатність, легенева емболія, пневмонія та пневмоторакс. Багато пацієнтів із ХОЗЛ помилково вважають, що мають астму.[16] Різниця між астмою та ХОЗЛ полягає у симптомах, наявності звички до куріння та її інтенсивності, а також можливості відновлення повітряного потоку при використанні бронхолітичних засобів під час спірометрії.[53] Туберкульоз може проявлятися хронічним кашлем, тому його наявність слід перевіряти в регіонах підвищеної розповсюдженості.[9] Менш розповсюджені хвороби із подібними симптомами включають бронхолегеневу дисплазію та облітеруючий бронхіоліт.[51] Під час хронічного бронхіту повітряний потік залишається нормальним, тому його не відносять до ХОЗЛ.[2]
Профілактика
[ред. код]Більшість випадків ХОЗЛ можна потенційно попередити, зменшуючи контакт із димом та покращуючи якість повітря.[29] Щорічне протигрипозне щеплення для пацієнтів із ХОЗЛ зменшує кількість загострень, госпіталізацій та смертей.[54][55] Корисною також може бутипневмококова вакцинаціяref name=Mackay2012/>
Припинення куріння
[ред. код]Утримання від того, щоб почати курити — ось ключовий аспект профілактики ХОЗЛ.[56] Політика урядів, установ із охорони здоров’я та організацій із боротьби проти куріння може зменшити кількість курців, переконуючи людей не починати та заохочуючи їх кидати.[57] Заборона куріння у громадських місцях та на роботі є важливим заходом із зменшення контакту зі вторинним димом, і хоча вже у багатьох місцях така заборона діє, рекомендується і далі збільшувати кількість таких місць.[29]
Для курців припинення куріння є єдиним способом уповільнити прогресування ХОЗЛ.[58] Навіть на пізній стадії захворювання відмова від куріння може зменшити швидкість погіршення функціонування легень та затримати настання інвалідності і смерті.[59] Припинення куріння починається з рішення кинути, за яким слідує спроба відмовитися. Часто перед досягненням довгострокового утримання потрібно декілька спроб.[57] Спроби протягом 5 років приводять до успіху 40% людей.[60]
Деякі курці можуть досягти довгострокового утримання лише за допомогою сили волі. Однак тютюн викликає дуже сильне звикання,[61] тому багатьом курцям потрібна додаткова підтримка. Шанси кинути курити збільшуються при використанні соціальної підтримки, залучення до програми припинення куріння, а також прийняття ліків, таких як нікотинозамінна терапія, бупропіон або вареніциклін.[57][60]
Захворювання на робочому місці
[ред. код]Для зменшення вірогідності розвитку ХОЗЛ у тих, хто працює в галузях високого ризику — як-от вугледобування, будівництво та кладка каменю — було розроблено низку заходів.[29] Серед них: запровадження офіційної політики профілактики,[29] проведення тренінгів для працівників і керівництва щодо ризиків, заохочення відмови від куріння, перевірка працівників на предмет перших симптомів ХОЗЛ, використання респіраторів та контроль утворення пилу.[62][63] Ефективно контролювати пил можна шляхом покращення вентиляції, використання водних спреїв та технологій видобування, які зводять до мінімуму утворення пилу.[64] Якщо у працівника розвивається ХОЗЛ, подальшого ушкодження легень можна уникнути, нейтралізувавши постійний контакт із пилом — наприклад, змінивши його робочі обов’язки.[65]
Забруднення повітря
[ред. код]Якість повітря як у приміщеннях, так і на вулиці, можна покращити для попередження ХОЗЛ або уповільнення прогресування існуючої хвороби.[29] Це можна зробити, запровадивши офіційну політику, а також заохочуючи культурні зміни та особисте залучення.[66]
Багато розвинених країн успішно підвищили якість зовнішнього повітря за допомогою запровадження відповідних норм. Завдяки цьому функціонування легень у широких кіл населення покращилося.ref name=Piro2012/> Пацієнти з ХОЗЛ можуть відчувати менше симптомів, якщо не виходитимуть на вулицю в ті дні, коли якість повітря там погана.[4]
Ключовим заходом є зменшення контакту з димом від палива, що використовується для приготування їжі та обігріву приміщень.[66] Печі належної якості можуть покращити якість повітря у будівлях на 85%.[29] --> Використання альтернативних джерел енергії, таких як сонячні кухні та електричний обігрів, є ефективним, так само як і використання керосину або вугілля замість біомаси.[29]
Догляд
[ред. код]Відомого способу лікування ХОЗЛ невідомо, але можна полегшити симптоми та уповільнити його прогресування.[56] Основні цілі догляду — зменшити фактори ризику, стабілізувати ХОЗЛ, попередити та лікувати загострення, а також лікувати супутні хвороби.[4] Єдині заходи, що справді зменшують смертність, — це припинення куріння та додатковий кисень.[67] Припинення куріння зменшує ризик смертності на 18%.ref name=Lancet2012/> Серед інших рекомендацій: протигрипозне щеплення щороку, пневмококова вакцинація кожні 5 років, зменшення контакту з забрудненим зовнішнім повітрям.ref name=Lancet2012/> Для пацієнтів із важким ступенем хвороби симптоми може полегшити паліативний догляд, при якому морфій зменшує відчуття задишки.[68] Для підтримки дихання може використовуватися неінвазивна вентиляція.[68]
Фізичні вправи
[ред. код]Легенева реабілітація — це програма з фізичних вправ, медичного догляду та консультування, що проводиться з метою допомоги хворому.[69] Пацієнтам із нещодавніми загостреннями легенева реабілітація покращує загальну якість життя та здатність до фізичної діяльності, а також зменшує рівень смертності.[70] Крім того, програма збільшує відчуття контролю людини над своєю хворобою та емоціями.[71] Дихальні вправи самі по собі мають лише обмежений вплив.[15]
На симптоми, ступінь інвалідності та прогноз ХОЗЛ може вплинути недостатня або надмірна вага. Пацієнти з ХОЗЛ і недостатньою вагою можуть зміцнити дихальні м’язи, збільшивши кількість споживаних калорій.[4] У комбінації з регулярними фізичними вправами або програмою легеневої реабілітації це може полегшити симптоми ХОЗЛ. Додаткове харчування може стати в нагоді й для тих, хто недоїдає.[72]
Бронхолітичні засоби
[ред. код]Бронхолітичні засоби є основними ліками, що використовуються через інгалятори[3] і загалом мають дуже невелику користь.[73] Існує два основні види: β2 агоністи та антихолінергіки; обидва існують у формах, що мають довготермінову та короткотермінову дію. Вони зменшують задишку, хрипіння та дають змогу займатися фізичними вправами, завдяки чому покращується якість життя.[74] Поки незрозуміло, чи впливають вони на прогресування самої хвороби.[3]
Для пацієнтів із легкою формою захворювання рекомендуються речовини короткострокової дії по мірі необхідності.[3] Для пацієнтів із тяжчою хворобою рекомендуються речовини довгострокової дії.[3] Якщо бронхолітичні засоби довгострокової дії мають недостатній ефект, до них зазвичай додають кортикостероїди в інгаляціях.[3] Що ж до речовин довгострокової дії, поки незрозуміло, яка з них є кращою — тіотропій (антихолінергик довгострокової дії) або бета-агоністи довгострокової дії; варто спробувати обидва варіанти і продовжувати приймати той, який є більш ефективним.[75] Обидва види речовин зменшують ризик гострих ускладнень на 15-25%.ref name=Lancet2012/> При використанні обох одночасно повідомляють про додаткові переваги, однак ці переваги не досить значні.[76]
Існує декілька короткострокових β2 агоністів, включно із салбутамолом (Вентоліном) та тербуталіном.[77] Вони трохи полегшують симптоми на чотири-шість годин.[77] β2 агоністи довгострокової дії, такі як салметерол та формотерол, часто використовуються в якості терапії підтримки. Деякі вважають, що переваги від них обмежені,[78] однак інші розглядають докази таких переваг як підтверджені. ref>Spencer, S; Karner, C; Cates, CJ; Evans, DJ (Dec 7, 2011). Spencer, Sally (ред.). Inhaled corticosteroids versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews (12): CD007033. doi:10.1002/14651858.CD007033.pub3. PMID 22161409.</ref>[79] Довгостроковий прийом цих ліків пацієнтами з ХОЗЛ є безпечним[80]; побічні ефекти включають тремтіння та серцебиття.[3] При використанні зі стероїдами в інгаляціях вони збільшують ризик пневмонії.[3] У той час як стероїди та бета-агоністи довгострокової дії можуть діяти краще при одночасному прийомі,ref name=Cave2011/> незрозуміло, чи варта ця незначна перевага більшого ризику.[81]
При ХОЗЛ використовуються два основні види холінергіків: іпратропій та [[тіотропій]. Іпратропій є речовиною короткострокової дії, у той час як тіотропій має довгий строк дії. Тіотропій пов’язують із зменшенням кількості ускладнень та покращеною якістю життя,[82]; у цьому аспекті він кращий, ніж іпратропій.[83] Він не впливає на смертність чи загальний рівень госпіталізації.[84] Антихолінергіки можуть викликати сухість у роті та неприємні симптомі в сечовому тракті.[3] Вони також пов’язані зі збільшеним ризиком сердечних захворювань та інсульту.[85][86] Аклідіній, ще один медичний засіб довгострокової дії, який з’явився на ринку в 2012 році, використовується як альтернатива тіотропію.[87][88]
Кортикостероїди
[ред. код]Кортикостероїди зазвичай використовуються для інгаляцій, але можуть також бути і в пігулках для лікування та профілактики гострих ускладнень. Хоча кортикостероїди в інгаляціях не показали позитивного впливу на пацієнтів із легкою формою ХОЗЛ, вони зменшують інтенсивність ускладнень у пацієнтів із помірною або важкою формою хвороби.[89] При використанні в комбінації з бета-агоністами вони зменшують смертність більше, ніж бета-агоністи довгострокової дії чи кортикостероїди окремо.[90] Самі по собі вони не впливають на загальний рівень смертності протягом одного року та пов’язані зі збільшенням кількості випадків пневмонії.[67] Незрозуміло, чи впливають вони на прогресування самої хвороби.[3] Довгострокове лікування стероїдними пігулками також пов’язують із значними побічними ефектами..[77]
Інші медичні засоби
[ред. код]Антибіотики довгострокового вживання, особливо з класу макролідів — наприклад, еритроміцин, — зменшують частоту ускладнень у пацієнтів, які зазвичай мають два або більше ускладнень на рік. ref name=Mammen2012>Mammen MJ, Sethi S (2012). Macrolide therapy for the prevention of acute exacerbations in chronic obstructive pulmonary disease. Pol. Arch. Med. Wewn. 122 (1–2): 54—9. PMID 22353707.</ref>[91] Ця практика може бути фінансово ефективною для певних країн світу.[92] Аргументи проти їхнього використання включають розвиток резистентності до антибіотиків та проблеми зі слухом при вживанні азітроміцину.[91] Метилксантини, такі як теофілін, зазвичай роблять більше шкоди, ніж користі, і тому не рекомендуються,[93] але можуть використовуватись як другорядна діюча речовина для пацієнтів, яким не допомагають інші засоби.[4] Муколітики можуть бути корисними для деяких пацієнтів, що страждають від дуже густого слизу, але зазвичай не потрібні.[54] Вживання ліків від кашлю не рекомендується.[77]
Кисень
[ред. код]Додатковий кисень рекомендовано для пацієнтів із низьким рівнем кисню в стані спокою (парціальний тиск кисню менше 50–55 РаО2 або з кисневим насиченням менше 88%).[77][94] У цій групі пацієнтів він зменшує ризик серцевого нападу і смерті при використанні протягом 15 годин на день[77][94] і може покращити здатність до виконання фізичних вправ.[95] Для пацієнтів із нормальним або трохи зниженим рівнем кисню додатковий кисень може полегшити задишку.[96] Якщо отримувачі кисневої терапії продовжують курити, користі від неї дуже мало і, крім того, існує ризик пожежі.[97] У цій ситуації деякі джерела рекомендують не вдаватися до такого способу лікування.[98] Під час гострих ускладнень кисневої терапії потребує багато пацієнтів; використання високих концентрацій кисню без урахування рівня насиченості організму пацієнта киснем може призвести до підвищення рівня вуглекислого газу та погіршення самопочуття.[99][100] Для пацієнтів із високим ризиком збільшення рівня вуглекислого газу рекомендується 88–92% насичення киснем, а для тих, у кого цього ризику немає — 94-98%.[100]
Хірургічне втручання
[ред. код]Пацієнтам із дуже важкою формою захворювання часом допомагає хірургічне втручання, яке може включати трансплантацію легень або хірургічне зменшення об’єму легень.[3] Під час хірургічного зменшення об’єму легень видаляються їхні частини, найбільш уражені емфіземою, завдяки чому відносно неушкоджена решта може розширитися і працювати краще.[77] У випадку дуже важкої форми ХОЗЛ може здійснюватися трансплантація легень, особливо для молодих пацієнтів.[77]
Ускладнення
[ред. код]Гострі ускладнення зазвичай лікують шляхом частішого використання бронхолітичних засобів короткострокової дії.[3] Найбільше використовується комбінація короткострокових бета-агоністів в інгаляціях та антихолінергіків.[37] Ці ліки можна приймати через інгалятор відмірених доз із фіксатором або через розпилювач; обидва пристрої є однаково ефективними.[37] Розпилення може бути легшим для тих, хто почувається гірше.[37]
Пероральні кортикостероїди покращують шанси на одужання і зменшують загальну тривалість симптомів.[3][37] Для пацієнтів із важкими ускладненнями антибіотики покращують наслідки хвороби.[101] Можна використовувати цілу низку різних антибіотиків: амоксицилін, доксицилін або азитроміцин; незрозуміло, чи якийсь із них є кращим за інші.[54] Для пацієнтів із менш важкими формами хвороби чітких доказів щодо переваг певного засобу немає.[101]
Неінвазивна вентиляція позитивним тиском для пацієнтів із гострим підвищенням рівнів CO2 (розлад дихання типу 2) зменшує вірогідність смерті від розладу або потреби в інтенсивному медичному догляді з метою проведення механічної вентиляції.[3] Крім того, теофілін може вплинути на тих пацієнтів, які не реагують на інші засоби.[3] Госпіталізації вимагають менш ніж 20% ускладнень.[37] Для пацієнтів без ацидозу внаслідок розладу дихання домашній догляд («лікарня вдома») може в деяких випадках допомогти уникнути госпіталізації.[37][102]
Прогноз
[ред. код]
no data ≤110 110–220 220–330 330–440 440–550 550–660 | 660–770 770–880 880–990 990–1100 1100–1350 ≥1350 |
ХОЗЛ зазвичай поступово погіршується з часом і врешті-решт може призвести до смерті. За розрахунками, 3% усіх випадків інвалідності пов’язані з ХОЗЛ.[104] Частка інвалідності внаслідок ХОЗЛ в усьому світі зменшилася з 1999 по 2010 рік завдяки покращеній якості повітря у приміщеннях, перш за все в Азії.[104] Загальна кількість років, протягом яких люди живуть із інвалідністю внаслідок ХОЗЛ, збільшилася. [105]
Темп прогресування ХОЗЛ залежить від наявності факторів, що сприяють негативному результату, включаючи: тяжку обструкцію дихальних шляхів, погану фізичну форму, задишку, недостатню вагу або надмірну вагу, застійну серцеву недостатність, постійне паління і часті загострення.[4] Довгострокові результати ХОЗЛ можна оцінити за допомогою індексу BODE, що дає оцінку нуля до десяти залежно від FEV1, ІМТ, відстані, яку пацієнт проходить за шість хвилин, і модифікованої шкали для оцінки задишки Ради медичних досліджень.[106] Значна втрата ваги є поганим знаком.[2] Результати спірометрії також є надійним провісником майбутнього розвитку захворювання, але не настільки хорошим, як індекс BODE.[2][10]
Епідеміологія
[ред. код]У всьому світі, починаючи з 2010 року, на ХОЗЛ хворіли приблизно 329 мільйонів людей (4,8% населення); це захворювання дещо частіше зустрічається серед чоловіків, ніж серед жінок.[105] Цю цифру можна порівняти з 64 млн хворих у 2004 році.[107] Зростання захворюваності у країнах, що розвиваються, в період з 1970 по 2000-й рік, як вважають, пов'язане зі збільшенням рівнів паління в цьому регіоні, збільшенням чисельності населення і старінням населення у зв'язку з меншою кількістю смертей від інших причин, таких як інфекційні захворювання.[3] У деяких розвинених країнах відбулося зростання рівню захворюваності, в інших він залишився стабільним, а ще в інших відбулося зменшення поширеності ХОЗЛ.[3] Глобальні показники, як очікується, будуть продовжувати зростати, оскільки як фактори ризику залишаються поширеними, а населення продовжує старіти.[56]
У період з 1990 по 2010 рік число смертей від ХОЗЛ незначно знизилося з 3,1 млн до 2,9 млн.[108]В цілому ХОЗЛ є четвертою за значимістю причиною смерті[3] В деяких країнах смертність знизилася у чоловіків, але збільшилася у жінок.[109] Це, швидше за все, викликано те, що рівні паління серед жінок і чоловіків стають дедалі більш схожими.[2] ХОЗЛ частіше зустрічається у літніх людей;[1] воно трапляється у 34-200 з 1000 чоловік у віці старше 65 років, залежно від популяції, що розглядається.[1][52]
В Англії, за оцінками, 0,84 млн осіб (з 50 млн) мають діагноз ХОЗЛ; що означає, що приблизно одній людині з 59 ставлять діагноз ХОЗЛ в якийсь момент її життя. У найбільш соціально і економічно нерозвинених частинах країни в одного з 32 чоловік було діагностовано ХОЗЛ, порівняно з одним з 98 в найбагатших районах.[110] У США приблизно у 6,3% дорослого населення, загалом близько 15 мільйон чоловік, було діагностовано ХОЗЛ.[111] 25 млн чоловік люди можуть мати ХОЗЛ, якщо включити на даний час недіагностовані випадки.[112] У 2011 році налічувалося близько 730 000 випадків госпіталізації в США з приводу ХОЗЛ.[113]
Історія
[ред. код]
Слово "емфізема" походить від грецької ἐμφυσᾶν emphysan, що означає "роздувати", - яке в свою чергу складається з ἐν en, що означає "в", і φυσᾶν physan, що означає "подих, вибух".[114] Термін «хронічний бронхіт» почали використовувати з 1808 року,[115] в той час як термін ХОЗЛ, як вважають, вперше був використаний у 1965 році.[116] Раніше це захворювання було відоме під кількома різними назвами, включаючи: хронічне обструктивне бронхолегеневе захворювання, хронічне обструктивне захворювання дихальних шляхів, хронічна обструкція дихальних шляхів, хронічне обмеження швидкості повітряного потоку, хронічна обструктивна хвороба легень, неспецифічне хронічне легеневе захворювання і дифузний обструктивний синдром.[116] -> Терміни «хронічний бронхіт» та «емфізема» були офіційно визначені в 1959 році на гостьовому симпозіумі CIBA, і в 1962 році на засіданні комітету з питань діагностичних стандартів Американського торакального суспільства.[116]
Ранні опису ймовірних випадків емфіземи включають: у 1679 опис Т. Боне стану "об'ємних легенів" і в 1769 році опис Джованні Морганьї легенів, які були "надуті повітрям".[116][117] У 1721 році Руйш зробив перші малюнки емфіземи.[117] Вони супроводжувалися фотографіями, зробленими Метью Бейлі в 1789 році, й описом руйнівного характеру хвороби.[116] -> У 1814 році Чарльз Бадхем використовував термін "катар", щоб описати кашель і виділення надмірного слизу при хронічному бронхіті.[116] -> Рене Лаеннек, лікар, який винайшов стетоскоп, використав термін "емфізема" у своїй книзі Трактат про захворювання органів грудної клітини і непрямої аускультації (1837 рік), щоб описати легені, які не здулися під час розтину.[116] -> Він відзначив, що це сталося через те, що вони були наповнені повітрям, і дихальні шляхи були заповнені слизом.[116] -> У 1842 році Джон Хатчінсон винайшов спірометр, за допомогою якого можна виміряти життєву ємність легенів.[116] -> Тим не менш, його спірометр міг виміряти тільки обсяг, а не повітряний потік.[116] ->. Тиффно і Пінеллі у 1947 році описали принципи виміру повітряного потоку.[116]
У 1953 році д-р Джордж Л. Уолботт, американський алерголог, вперше описав нову хворобу, яку він назвав "респіраторний синдром курця" у журналі Американської медичної асоціації за 1953 рік. Це був перший зв'язок, встановлений між курінням тютюну і хронічним респіраторним захворюванням.[118]
Ранні методи лікування включали часник, корицю і іпекакуану, серед інших.[115] Cучасні методи лікування були розроблені у другій половині 20-го століття. Додаткові бронходилататори, такі як сальбутамол, були розроблені в 1970-х роках; використання Лабаса почалося в середині 1990-х.[119]
Суспільство і культура
[ред. код]ХОЗЛ називали "легенями курця".[120] Хворих на емфізему також називали «рожевими пихкунами» або «типом А» через частий у них рожевий колір обличчя, швидкий темп дихання та стиснуті губи,[121][122] а людей із хронічним бронхітом називали «блакитними опухликами» або «типом В» через часто блакитнуватий колір шкіри і губ через низький рівень кисню та опухлі щиколотки.[122][123] Ця термінологія більше не вважається корисною, оскільки більшість людей з ХОЗЛ мають комбінацію обох видів симптомів.[2][122]
Системи охорони здоров'я багатьох країн відчувають труднощі з організацією належного виявлення, діагностики та лікування хворих на ХОЗЛ; Британський Департамент охорони здоров'я визначив це як основне питання для Національної служби охорони здоров'я і запровадив спеціальну стратегію для вирішення цих проблем.[124]
Економіка
[ред. код]У всьому світі, починаючи з 2010 року, ХОЗЛ, за оцінками, призвело до економічних витрат у розмірі 2,1 трильйонів доларів США, половина цієї суми припадає на країни, що розвиваються.[8] З цієї загальної суми близько 1,9 трлн доларів становлять прямі витрати, такі як медична допомога, в той час як 0,2 & NBSP; трлн доларів становлять непрямі витрати, такі як прогули.[125] Очікується, що ця цифра зросте більш ніж у два рази в найближчі 20 років.[8] В Європі на ХОЗЛ припадає 3% витрат на охорону здоров'я.[1] В США, витрати на захворювання оцінюються у розмірі 50 млрд доларів США; більшість цих витрат пов'язана із загостренням.[1] ХОЗЛ було однією з найбільш затратних захворювань у лікарнях США в 2011 році; витрати на нього складали близько 5,7 мільярда доларів.[113]
Дослідження
[ред. код]Інфлаксімаб, антитіло, що подавляє імунну систему, було випробувано при ХОЗЛ, але не було отримано жодних доказів користі, з можливістю шкоди.[126] Рофлуміласт потенційно може зменшити кількість загострень, але, вочевидь, не призводить до зміни якості життя.[3] Кілька нових препаратів тривалої дії знаходяться у стадії розробки. [3] Досліджується лікування стовбуровими клітинами.[127] Тоді як існують обнадійливі результати дослідження і безпечного використання у тварин, існує мало даних про його застосування у людей станом на 2014 рік.[128]
Інші тварини
[ред. код]Хронічне обструктивне захворювання легень може виникнути також і в інших тварин, інколи від впливу сигаретного диму.[129][130] Більшість випадків захворювання, проте, мають порівняно м'яку форму.[131] У коней ця хвороба також називається рецидивуюча обструкція дихальних шляхів і, як правило, виникає через алергічну реакції на солому, що містить грибки.[132] ХОЗЛ часто діагностують у старих собак.[133]
Посилання
[ред. код]- ↑ а б в г д е ж и к л м н п р с т у ф х ц ш щ ю я аа аб ав Vestbo, Jørgen (2013). Definition and Overview (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. с. 1—7.
- ↑ а б в г д е ж и к л м н п р Reilly, John J.; Silverman, Edwin K.; Shapiro, Steven D. (2011). Chronic Obstructive Pulmonary Disease. У Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph (ред.). Harrison's Principles of Internal Medicine (вид. 18th). McGraw Hill. с. 2151—9. ISBN 978-0-07-174889-6.
- ↑ а б в г д е ж и к л м н п р с т у ф х ц ш щ ю я аа Decramer M, Janssens W, Miravitlles M (April 2012). Chronic obstructive pulmonary disease. Lancet. 379 (9823): 1341—51. doi:10.1016/S0140-6736(11)60968-9. PMID 22314182.
- ↑ а б в г д е ж и к л м Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J (September 2007). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am. J. Respir. Crit. Care Med. 176 (6): 532—55. doi:10.1164/rccm.200703-456SO. PMID 17507545.
- ↑ Nathell L, Nathell M, Malmberg P, Larsson K (2007). COPD diagnosis related to different guidelines and spirometry techniques. Respir. Res. 8 (1): 89. doi:10.1186/1465-9921-8-89. PMC 2217523. PMID 18053200.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ The 10 leading causes of death in the world, 2000 and 2011. World Health Organization. July 2013. Процитовано 29 листопада 2013.
- ↑ Mathers CD, Loncar D (November 2006). Projections of Global Mortality and Burden of Disease from 2002 to 2030. PLoS Med. 3 (11): e442. doi:10.1371/journal.pmed.0030442. PMC 1664601. PMID 17132052.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в Lomborg, Bjørn (2013). Global problems, local solutions : costs and benefits. Cambridge University Pres. с. 143. ISBN 978-1-107-03959-9.
- ↑ а б в г д е ж и к л м н п р с т у ф х ц Vestbo, Jørgen (2013). Diagnosis and Assessment (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. с. 9—17.
- ↑ а б в г д е ж National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- ↑ Mahler DA (2006). Mechanisms and measurement of dyspnea in chronic obstructive pulmonary disease. Proceedings of the American Thoracic Society. 3 (3): 234—8. doi:10.1513/pats.200509-103SF. PMID 16636091.
- ↑ What Are the Signs and Symptoms of COPD?. National Heart, Lung, and Blood Institute. 31 липня 2013. Процитовано 29 листопада 2013.
- ↑ MedlinePlus Encyclopedia Chronic obstructive pulmonary disease
- ↑ Morrison, [edited by] Nathan E. Goldstein, R. Sean (2013). Evidence-based practice of palliative medicine. Philadelphia: Elsevier/Saunders. с. 124. ISBN 978-1-4377-3796-7.
- ↑ а б Holland AE, Hill CJ, Jones AY, McDonald CF (2012). Holland, Anne E (ред.). Breathing exercises for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 10: CD008250. doi:10.1002/14651858.CD008250.pub2. PMID 23076942.
- ↑ а б в г д е Gruber, Phillip (November 2008). The Acute Presentation of Chronic Obstructive Pulmonary Disease In the Emergency Department: A Challenging Oxymoron. Emergency Medicine Practice. 10 (11).
- ↑ а б Weitzenblum E, Chaouat A (2009). Cor pulmonale. Chron Respir Dis. 6 (3): 177—85. doi:10.1177/1479972309104664. PMID 19643833.
- ↑ Cor pulmonale. Professional guide to diseases (вид. 9th). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2009. с. 120—2. ISBN 978-0-7817-7899-2.
- ↑ Mandell, editors, James K. Stoller, Franklin A. Michota, Jr., Brian F. (2009). The Cleveland Clinic Foundation intensive review of internal medicine (вид. 5th). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. с. 419. ISBN 978-0-7817-9079-6.
- ↑ Brulotte CA, Lang ES (May 2012). Acute exacerbations of chronic obstructive pulmonary disease in the emergency department. Emerg. Med. Clin. North Am. 30 (2): 223—47, vii. doi:10.1016/j.emc.2011.10.005. PMID 22487106.
- ↑ Spiro, Stephen (2012). Clinical respiratory medicine expert consult (вид. 4th). Philadelphia, PA: Saunders. с. Chapter 43. ISBN 978-1-4557-2329-4.
- ↑ World Health Organization (2008). WHO Report on the Global Tobacco Epidemic 2008: The MPOWER Package (PDF). Geneva: World Health Organization. с. 268—309. ISBN 92-4-159628-7.
- ↑ а б Ward, Helen (2012). Oxford Handbook of Epidemiology for Clinicians. Oxford University Press. с. 289—290. ISBN 978-0-19-165478-7.
- ↑ Laniado-Laborín, R (January 2009). Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21st century. International journal of environmental research and public health. 6 (1): 209—24. doi:10.3390/ijerph6010209. PMC 2672326. PMID 19440278.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Rennard, Stephen (2013). Clinical management of chronic obstructive pulmonary disease (вид. 2nd). New York: Informa Healthcare. с. 23. ISBN 978-0-8493-7588-0.
- ↑ а б Anita Sharma ; with a contribution by David Pitchforth ; forewords by Gail Richards; Barclay, Joyce (2010). COPD in primary care. Oxford: Radcliffe Pub. с. 9. ISBN 978-1-84619-316-3.
- ↑ Goldman, Lee (2012). Goldman's Cecil medicine (вид. 24th). Philadelphia: Elsevier/Saunders. с. 537. ISBN 978-1-4377-1604-7.
- ↑ а б Kennedy SM, Chambers R, Du W, Dimich-Ward H (December 2007). Environmental and occupational exposures: do they affect chronic obstructive pulmonary disease differently in women and men?. Proceedings of the American Thoracic Society. 4 (8): 692—4. doi:10.1513/pats.200707-094SD. PMID 18073405.
- ↑ а б в г д е ж и к л м н п Pirozzi C, Scholand MB (July 2012). Smoking cessation and environmental hygiene. Med. Clin. North Am. 96 (4): 849—67. doi:10.1016/j.mcna.2012.04.014. PMID 22793948.
- ↑ Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM (September 2006). Global burden of COPD: systematic review and meta-analysis. Eur. Respir. J. 28 (3): 523—32. doi:10.1183/09031936.06.00124605. PMID 16611654.
- ↑ а б Devereux, Graham (2006). Definition, epidemiology and risk factors. BMJ. 332 (7550): 1142—4. doi:10.1136/bmj.332.7550.1142. PMC 1459603. PMID 16690673.
- ↑ Laine, Christine (2009). In the Clinic: Practical Information about Common Health Problems. ACP Press. с. 226. ISBN 978-1-934465-64-6.
- ↑ а б Barnes, Peter J.; Drazen, Jeffrey M.; Rennard, Stephen I.; Thomson, Neil C., ред. (2009). Relationship between cigarette smoking and occupational exposures. Asthma and COPD: Basic Mechanisms and Clinical Management. Amsterdam: Academic. с. 464. ISBN 978-0-12-374001-4.
- ↑ Rushton, Lesley (2007). Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica. Reviews on Environmental Health. 22 (4): 255—72. doi:10.1515/REVEH.2007.22.4.255. PMID 18351226.
- ↑ а б в г Foreman MG, Campos M, Celedón JC (July 2012). Genes and chronic obstructive pulmonary disease. Med. Clin. North Am. 96 (4): 699—711. doi:10.1016/j.mcna.2012.02.006. PMC 3399759. PMID 22793939.
- ↑ Brode SK, Ling SC, Chapman KR (September 2012). Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease. CMAJ. 184 (12): 1365—71. doi:10.1503/cmaj.111749. PMC 3447047. PMID 22761482.
- ↑ а б в г д е ж Vestbo, Jørgen (2013). Management of Exacerbations (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. с. 39—45.
- ↑ а б в Dhar, Raja (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. с. 1056. ISBN 978-93-5025-073-0.
- ↑ Palange, Paolo (2013). ERS Handbook of Respiratory Medicine. European Respiratory Society. с. 194. ISBN 978-1-84984-041-5.
- ↑ Lötvall, Jan (2011). Advances in combination therapy for asthma and COPD. Chichester, West Sussex: John Wiley & Sons. с. 251. ISBN 978-1-119-97846-6.
- ↑ Barnes, Peter (2009). Asthma and COPD : basic mechanisms and clinical management (вид. 2nd). Amsterdam: Academic. с. 837. ISBN 978-0-12-374001-4.
- ↑ Hanania, Nicola (9 грудня 2010). COPD a Guide to Diagnosis and Clinical Management (вид. 1st). Totowa, NJ: Springer Science+Business Media, LLC. с. 197. ISBN 978-1-59745-357-8.
- ↑ а б Beasley, V; Joshi, PV; Singanayagam, A; Molyneaux, PL; Johnston, SL; Mallia, P (2012). Lung microbiology and exacerbations in COPD. International journal of chronic obstructive pulmonary disease. 7: 555—69. doi:10.2147/COPD.S28286. PMC 3437812. PMID 22969296.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Murphy DMF, Fishman AP (2008). Chapter 53. Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 913. ISBN 0-07-145739-9.
- ↑ а б Calverley PM, Koulouris NG (2005). Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology. Eur Respir J. 25 (1): 186—199. doi:10.1183/09031936.04.00113204. PMID 15640341.
- ↑ Currie, Graeme P. (2010). ABC of COPD (вид. 2nd). Chichester, West Sussex, UK: Wiley-Blackwell, BMJ Books. с. 32. ISBN 978-1-4443-2948-3.
- ↑ O'Donnell DE (2006). Hyperinflation, Dyspnea, and Exercise Intolerance in Chronic Obstructive Pulmonary Disease. The Proceedings of the American Thoracic Society. 3 (2): 180—4. doi:10.1513/pats.200508-093DO. PMID 16565429.
- ↑ а б в г д е Qaseem A, Wilt TJ, Weinberger SE, Hanania NA, Criner G, van der Molen T, Marciniuk DD, Denberg T, Schünemann H, Wedzicha W, MacDonald R, Shekelle P (August 2011). Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann. Intern. Med. 155 (3): 179—91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
- ↑ а б Young, Vincent B. (2010). Blueprints medicine (вид. 5th). Philadelphia: Wolters Kluwer Health/Lippincott William & Wilkins. с. 69. ISBN 978-0-7817-8870-0.
- ↑ COPD Assessment Test (CAT). American Thoracic Society. Процитовано 29 листопада 2013.
- ↑ а б National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- ↑ а б Torres M, Moayedi S (May 2007). Evaluation of the acutely dyspneic elderly patient. Clin. Geriatr. Med. 23 (2): 307—25, vi. doi:10.1016/j.cger.2007.01.007. PMID 17462519.
- ↑ BTS COPD Consortium (2005). Spirometry in practice - a practical guide to using spirometry in primary care. с. 8—9. Процитовано 25 серпня 2014.
- ↑ а б в Mackay AJ, Hurst JR (July 2012). COPD exacerbations: causes, prevention, and treatment. Med. Clin. North Am. 96 (4): 789—809. doi:10.1016/j.mcna.2012.02.008. PMID 22793945.
- ↑ Poole PJ, Chacko E, Wood-Baker RW, Cates CJ (2006). Poole, Phillippa (ред.). Influenza vaccine for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev (1): CD002733. doi:10.1002/14651858.CD002733.pub2. PMID 16437444.
- ↑ а б в Vestbo, Jørgen (2013). Introduction. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. xiii—xv.
- ↑ а б в Policy Recommendations for Smoking Cessation and Treatment of Tobacco Dependence. World Health Organization. с. 15—40. ISBN 978-92-4-156240-9.
- ↑ Jiménez-Ruiz CA, Fagerström KO (March 2013). Smoking cessation treatment for COPD smokers: the role of counselling. Monaldi Arch Chest Dis. 79 (1): 33—7. PMID 23741944.
- ↑ Kumar P, Clark M (2005). Clinical Medicine (вид. 6th). Elsevier Saunders. с. 900—1. ISBN 0-7020-2763-4.
- ↑ а б Tønnesen P (March 2013). Smoking cessation and COPD. Eur Respir Rev. 22 (127): 37—43. doi:10.1183/09059180.00007212. PMID 23457163.
- ↑ Why is smoking addictive?. NHS Choices. 29 грудня 2011. Процитовано 29 листопада 2013.
- ↑ Smith, Barbara K. Timby, Nancy E. (2005). Essentials of nursing : care of adults and children. Philadelphia: Lippincott Williams & Wilkins. с. 338. ISBN 978-0-7817-5098-1.
- ↑ Rom, William N.; Markowitz, Steven B., ред. (2007). Environmental and occupational medicine (вид. 4th). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. с. 521—2. ISBN 978-0-7817-6299-1.
- ↑ Wet cutting. Health and Safety Executive. Процитовано 29 листопада 2013.
- ↑ George, Ronald B. (2005). Chest medicine : essentials of pulmonary and critical care medicine (вид. 5th). Philadelphia, PA: Lippincott Williams & Wilkins. с. 172. ISBN 978-0-7817-5273-2.
- ↑ а б Vestbo, Jørgen (2013). Management of Stable COPD. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. с. 31—8.
- ↑ а б Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E (November 2008). Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 300 (20): 2407—16. doi:10.1001/jama.2008.717. PMID 19033591.
- ↑ а б Carlucci A, Guerrieri A, Nava S (December 2012). Palliative care in COPD patients: is it only an end-of-life issue?. Eur Respir Rev. 21 (126): 347—54. doi:10.1183/09059180.00001512. PMID 23204123.
- ↑ COPD — Treatment. U.S. National Heart Lung and Blood Institute. Процитовано 23 липня 2013.
- ↑ Puhan MA, Gimeno-Santos E, Scharplatz M, Troosters T, Walters EH, Steurer J (2011). Puhan, Milo A (ред.). Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev (10): CD005305. doi:10.1002/14651858.CD005305.pub3. PMID 21975749.
- ↑ Lacasse Y, Goldstein R, Lasserson TJ, Martin S (2006). Lacasse, Yves (ред.). Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev (4): CD003793. doi:10.1002/14651858.CD003793.pub2. PMID 17054186.
- ↑ Ferreira IM, Brooks D, White J, Goldstein R (2012). Ferreira, Ivone M (ред.). Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 12: CD000998. doi:10.1002/14651858.CD000998.pub3. PMID 23235577.
- ↑ van Dijk WD, van den Bemt L, van Weel C (2013). Megatrials for bronchodilators in chronic obstructive pulmonary disease (COPD) treatment: time to reflect. J Am Board Fam Med. 26 (2): 221—4. doi:10.3122/jabfm.2013.02.110342. PMID 23471939.
- ↑ Liesker JJ, Wijkstra PJ, Ten Hacken NH, Koëter GH, Postma DS, Kerstjens HA (February 2002). A systematic review of the effects of bronchodilators on exercise capacity in patients with COPD. Chest. 121 (2): 597—608. doi:10.1378/chest.121.2.597. PMID 11834677.
- ↑ Chong J, Karner C, Poole P (2012). Chong, Jimmy (ред.). Tiotropium versus long-acting beta-agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 9: CD009157. doi:10.1002/14651858.CD009157.pub2. PMID 22972134.
- ↑ Karner C, Cates CJ (2012). Karner, Charlotta (ред.). Long-acting beta(2)-agonist in addition to tiotropium versus either tiotropium or long-acting beta(2)-agonist alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 4: CD008989. doi:10.1002/14651858.CD008989.pub2. PMID 22513969.
- ↑ а б в г д е ж и Vestbo, Jørgen (2013). Therapeutic Options (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. с. 19—30.
- ↑ Cave, AC.; Hurst, MM. (May 2011). The use of long acting β₂-agonists, alone or in combination with inhaled corticosteroids, in chronic obstructive pulmonary disease (COPD): a risk-benefit analysis. Pharmacol Ther. 130 (2): 114—43. doi:10.1016/j.pharmthera.2010.12.008. PMID 21276815.
- ↑ Wang, J; Nie, B; Xiong, W; Xu, Y (April 2012). Effect of long-acting beta-agonists on the frequency of COPD exacerbations: a meta-analysis. Journal of clinical pharmacy and therapeutics. 37 (2): 204—11. doi:10.1111/j.1365-2710.2011.01285.x. PMID 21740451.
- ↑ Decramer ML, Hanania NA, Lötvall JO, Yawn BP (2013). The safety of long-acting β2-agonists in the treatment of stable chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 8: 53—64. doi:10.2147/COPD.S39018. PMC 3558319. PMID 23378756.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Nannini, LJ; Lasserson, TJ; Poole, P (Sep 12, 2012). Nannini, Luis Javier (ред.). Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 9: CD006829. doi:10.1002/14651858.CD006829.pub2. PMID 22972099.
- ↑ Karner C, Chong J, Poole P (2012). Karner, Charlotta (ред.). Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- ↑ Cheyne L, Irvin-Sellers MJ, White J (Sep 16, 2013). Cheyne, Leanne (ред.). Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews. 9 (9): CD009552. doi:10.1002/14651858.CD009552.pub2. PMID 24043433.
- ↑ Karner, C; Chong, J; Poole, P (Jul 11, 2012). Karner, Charlotta (ред.). Tiotropium versus placebo for chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- ↑ Singh S, Loke YK, Furberg CD (September 2008). Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 300 (12): 1439—50. doi:10.1001/jama.300.12.1439. PMID 18812535.
- ↑ Singh S, Loke YK, Enright P, Furberg CD (January 2013). Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications. Thorax. 68 (1): 114—6. doi:10.1136/thoraxjnl-2011-201275. PMID 22764216.
- ↑ Jones, P (Apr 2013). Aclidinium bromide twice daily for the treatment of chronic obstructive pulmonary disease: a review. Advances in therapy. 30 (4): 354—68. doi:10.1007/s12325-013-0019-2. PMID 23553509.
- ↑ Cazzola, M; Page, CP; Matera, MG (Jun 2013). Aclidinium bromide for the treatment of chronic obstructive pulmonary disease. Expert opinion on pharmacotherapy. 14 (9): 1205—14. doi:10.1517/14656566.2013.789021. PMID 23566013.
- ↑ Gartlehner G, Hansen RA, Carson SS, Lohr KN (2006). Efficacy and Safety of Inhaled Corticosteroids in Patients With COPD: A Systematic Review and Meta-Analysis of Health Outcomes. Ann Fam Med. 4 (3): 253—62. doi:10.1370/afm.517. PMC 1479432. PMID 16735528.
- ↑ Shafazand S (June 2013). ACP Journal Club. Review: inhaled medications vary substantively in their effects on mortality in COPD. Ann. Intern. Med. 158 (12): JC2. doi:10.7326/0003-4819-158-12-201306180-02002. PMID 23778926.
- ↑ а б Herath, SC; Poole, P (Nov 28, 2013). Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD). The Cochrane database of systematic reviews. 11: CD009764. doi:10.1002/14651858.CD009764.pub2. PMID 24288145.
- ↑ Simoens, S; Laekeman, G; Decramer, M (May 2013). Preventing COPD exacerbations with macrolides: a review and budget impact analysis. Respiratory medicine. 107 (5): 637—48. doi:10.1016/j.rmed.2012.12.019. PMID 23352223.
- ↑ Barr RG, Rowe BH, Camargo CA (2003). Barr, R Graham (ред.). Methylxanthines for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev (2): CD002168. doi:10.1002/14651858.CD002168. PMID 12804425.
- ↑ а б COPD Working, Group (2012). Long-term oxygen therapy for patients with chronic obstructive pulmonary disease (COPD): an evidence-based analysis. Ontario health technology assessment series. 12 (7): 1—64. PMC 3384376. PMID 23074435.
- ↑ Bradley JM, O'Neill B (2005). Bradley, Judy M (ред.). Short-term ambulatory oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev (4): CD004356. doi:10.1002/14651858.CD004356.pub3. PMID 16235359.
- ↑ Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A (2011). Abernethy, Amy (ред.). Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease. Cochrane Database Syst Rev (6): CD006429. doi:10.1002/14651858.CD006429.pub2. PMID 21678356.
- ↑ Chapman, Stephen (2009). Oxford handbook of respiratory medicine (вид. 2nd). Oxford: Oxford University Press. с. 707. ISBN 978-0-19-954516-2.
- ↑ Blackler, Laura (2007). Managing chronic obstructive pulmonary disease. Chichester, England: John Wiley & Sons. с. 49. ISBN 978-0-470-51798-7.
- ↑ Jindal, Surinder K (2013). Chronic Obstructive Pulmonary Disease. Jaypee Brothers Medical. с. 139. ISBN 978-93-5090-353-7.
- ↑ а б O'Driscoll, BR; Howard, LS; Davison, AG; British Thoracic, Society (October 2008). BTS guideline for emergency oxygen use in adult patients. Thorax. 63 (Suppl 6): vi1—68. doi:10.1136/thx.2008.102947. PMID 18838559.
- ↑ а б Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA (2012). Vollenweider, Daniela J (ред.). Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 12: CD010257. doi:10.1002/14651858.CD010257. PMID 23235687.
- ↑ Jeppesen, E; Brurberg, KG; Vist, GE; Wedzicha, JA; Wright, JJ; Greenstone, M; Walters, JA (16 травня 2012). Hospital at home for acute exacerbations of chronic obstructive pulmonary disease. The Cochrane database of systematic reviews. 5: CD003573. doi:10.1002/14651858.CD003573.pub2. PMID 22592692.
- ↑ WHO Disease and injury country estimates. World Health Organization. 2009. Процитовано Nov 11, 2009.
- ↑ а б Murray CJ, Vos T, Lozano R, Naghavi M, Flaxman AD, Michaud C, Ezzati M, Shibuya K, Salomon JA та ін. (December 2012). Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859): 2197—223. doi:10.1016/S0140-6736(12)61689-4. PMID 23245608.
{{cite journal}}: Недійсний|displayauthors=30(довідка); Явне використання «та ін.» у:|author=(довідка) - ↑ а б Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, Shibuya K, Salomon JA, Abdalla S, Aboyans V та ін. (December 2012). Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859): 2163—96. doi:10.1016/S0140-6736(12)61729-2. PMID 23245607.
{{cite journal}}: Недійсний|displayauthors=30(довідка); Явне використання «та ін.» у:|author=(довідка) - ↑ Medicine, prepared by the Department of Medicine, Washington University School of (2009). The Washington manual general internal medicine subspecialty consult (вид. 2nd). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. с. 96. ISBN 978-0-7817-9155-7.
- ↑ Chronic obstructive pulmonary disease (COPD) Fact sheet N°315. WHO. November 2012.
- ↑ Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R та ін. (December 2012). Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859): 2095—128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
{{cite journal}}: Недійсний|displayauthors=30(довідка); Явне використання «та ін.» у:|author=(довідка) - ↑ Rycroft CE, Heyes A, Lanza L, Becker K (2012). Epidemiology of chronic obstructive pulmonary disease: a literature review. Int J Chron Obstruct Pulmon Dis. 7: 457—94. doi:10.2147/COPD.S32330. PMC 3422122. PMID 22927753.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Simpson CR, Hippisley-Cox J, Sheikh A (2010). Trends in the epidemiology of chronic obstructive pulmonary disease in England: a national study of 51 804 patients. Brit J Gen Pract. 60 (576): 483—8. doi:10.3399/bjgp10X514729. PMC 2894402. PMID 20594429.
- ↑ Centers for Disease Control and Prevention (Nov 23, 2012). Chronic Obstructive Pulmonary Disease Among Adults — United States, 2011. Morbidity and Mortality Weekly Report. 61 (46): 938—43. PMID 23169314.
- ↑ Morbidity & Mortality: 2009 Chart Book on Cardiovascular, Lung, and Blood Diseases (PDF). National Heart, Lung, and Blood Institute.
- ↑ а б Torio CM, Andrews RM (2006). National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011: Statistical Brief #160. Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Agency for Health Care Policy and Research. PMID 24199255.
- ↑ Emphysema. Dictionary.com. Процитовано 21 листопада 2013.
- ↑ а б Ziment, Irwin (1991). History of the Treatment of Chronic Bronchitis. Respiration. 58 (Suppl 1): 37—42. doi:10.1159/000195969. PMID 1925077.
- ↑ а б в г д е ж и к л м Petty TL (2006). The history of COPD. Int J Chron Obstruct Pulmon Dis. 1 (1): 3—14. doi:10.2147/copd.2006.1.1.3. PMC 2706597. PMID 18046898.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Wright, Joanne L.; Churg, Andrew (2008). Pathologic Features of Chronic Obstructive Pulmonary Disease: Diagnostic Criteria and Differential Diagnosis (PDF). У Fishman, Alfred; Elias, Jack; Fishman, Jay; Grippi, Michael; Senior, Robert; Pack, Allan (ред.). Fishman's Pulmonary Diseases and Disorders (вид. 4th). New York: McGraw-Hill. с. 693—705. ISBN 978-0-07-164109-8.
- ↑ George L. Waldbott (1965). A struggle with Titans. Carlton Press. с. 6.
- ↑ Fishman AP (May 2005). One hundred years of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 171 (9): 941—8. doi:10.1164/rccm.200412-1685OE. PMID 15849329.
- ↑ Yuh-Chin, T. Huang (28 жовтня 2012). A clinical guide to occupational and environmental lung diseases. [New York]: Humana Press. с. 266. ISBN 978-1-62703-149-3.
- ↑ Pink Puffer - definition of Pink Puffer in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia. Medical-dictionary.thefreedictionary.com. Процитовано 23 липня 2013.
- ↑ а б в Weinberger, Steven E. (8 травня 2013). Principles of pulmonary medicine (вид. 6th). Philadelphia: Elsevier/Saunders. с. 165. ISBN 978-1-62703-149-3.
- ↑ Des Jardins, Terry (2013). Clinical Manifestations & Assessment of Respiratory Disease (вид. 6th). Elsevier Health Sciences. с. 176. ISBN 978-0-323-27749-5.
- ↑ An outcomes strategy for people with chronic obstructive pulmonary disease (COPD) and asthma in England (PDF). Department of Health. 18 липня 2011. с. 5. Процитовано 27 листопада 2013.
- ↑ Bloom, D (2011). The Global Economic Burden of Noncommunicable Diseases (PDF). World Economic Forum. с. 24.
- ↑ Nici, Linda (2011). Chronic Obstructive Pulmonary Disease: Co-Morbidities and Systemic Consequences. Springer. с. 78. ISBN 978-1-60761-673-3.
- ↑ Inamdar, AC; Inamdar, AA (Oct 2013). Mesenchymal stem cell therapy in lung disorders: pathogenesis of lung diseases and mechanism of action of mesenchymal stem cell. Experimental lung research. 39 (8): 315—27. doi:10.3109/01902148.2013.816803. PMID 23992090.
- ↑ Conese, M; Piro, D; Carbone, A; Castellani, S; Di Gioia, S (2014). Hematopoietic and mesenchymal stem cells for the treatment of chronic respiratory diseases: role of plasticity and heterogeneity. TheScientificWorldJournal. 2014: 859817. doi:10.1155/2014/859817. PMC 3916026. PMID 24563632.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Akers, R. Michael; Denbow, D. Michael (2008). Anatomy and Physiology of Domestic Animals. Arnes, AI: Wiley. с. 852. ISBN 978-1-118-70115-7.
- ↑ Wright, JL; Churg, A (December 2002). Animal models of cigarette smoke-induced COPD. Chest. 122 (6 Suppl): 301S—6S. doi:10.1378/chest.122.6_suppl.301S. PMID 12475805.
- ↑ Churg, A; Wright, JL (2007). Animal models of cigarette smoke-induced chronic obstructive lung disease. Contributions to microbiology. Contributions to Microbiology. 14: 113—25. doi:10.1159/000107058. ISBN 3-8055-8332-X. PMID 17684336.
- ↑ Marinkovic D, Aleksic-Kovacevic S, Plamenac P (2007). Cellular basis of chronic obstructive pulmonary disease in horses. Int. Rev. Cytol. International Review of Cytology. 257: 213—47. doi:10.1016/S0074-7696(07)57006-3. ISBN 978-0-12-373701-4. PMID 17280899.
- ↑ Miller MS, Tilley LP, Smith FW (January 1989). Cardiopulmonary disease in the geriatric dog and cat. Vet. Clin. North Am. Small Anim. Pract. 19 (1): 87—102. PMID 2646821.
Подальше читання
[ред. код]- Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013 (PDF). Global Initiative for Chronic Obstructive Lung Disease. Процитовано 29 листопада 2013.
- National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Qaseem, Amir; Wilt, TJ; Weinberger, SE; Hanania, NA; Criner, G; Van Der Molen, T; Marciniuk, DD; Denberg, T; Schünemann, H; Wedzicha, W; MacDonald, R; Shekelle, P; American College Of, Physicians; American College of Chest Physicians; American Thoracic, Society; European Respiratory, Society (2011). Diagnosis and Management of Stable Chronic Obstructive Pulmonary Disease: A Clinical Practice Guideline Update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Annals of Internal Medicine. 155 (3): 179—91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
Посилання
[ред. код]| Сторінки цієї категорії слід перемістити у конкретніші підкатегорії. Предмет цієї категорії є занадто обширним, тому в ній мають міститися лише статті загального характеру. Будь ласка, якщо можливо, використовуйте одну з підкатегорій. |
- DMOZ: [1]