Хінна кислота
| Хінна кислота | |
|---|---|
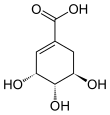
 Структурна формула
|
 Кульково-стрижнева модель
|
| Ідентифікатори | |
| Номер CAS | 77-95-2 |
| PubChem | 6508 |
| Номер EINECS |
201-072-8 |
| KEGG |
C00296 |
| Назва MeSH |
D02.241.223.268.637 і D02.241.511.764 |
| ChEBI | 17521 |
| RTECS |
GU8650000 |
| SMILES | O[C@]1(C[C@@H](O)[C@@H](O)[C@H](O)C1)C(O)=O |
| InChI | 1/C7H12O6/c8-3-1-7(13,6(11)12)2-4(9)5(3)10/h3-5,8-10,13H,1-2H2,(H,11,12)/t3-,4-,5-,7+/m1/s1 |
| Номер Бельштейна |
2212412 |
| Властивості | |
| Молекулярна формула | C7H12O6 |
| Молярна маса | 192.17 г/моль |
| Густина | 1.35 г/см3 |
| Тпл | 168°C |
| Небезпеки | |
| NFPA 704 | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Хінна кислота — це циклітол (циклічний поліол) та циклогексанкарбоксилова кислота. Це безбарвна тверда речовина, яку можна отримати з рослин. Хінна кислота пов'язана з відчуттям кислотності кави.
Сполуку отримують з кори хінного дерева, кавових зерен і кори евкаліпта кулястого.[1] Вона входить до складу tara tannins[en].
Європейська кропива дводомна, є ще одним поширеним джерелом цієї кислоти.
Також виробляється синтетично шляхом гідролізу хлорогенової кислоти. Хінна кислота також пов'язана зі сприйняттям кислотності кави.
Ця речовина була вперше виділена в 1790 році німецьким фармацевтом Фрідріхом Крістіаном Гофманом у місті Лер з хінного дерева.[2] Її перетворення в гіппурову кислоту шляхом метаболізму у тварин досліджував німецький хімік Едуард Лаутман у 1863 році.[3]
Біосинтез починається з перетворення глюкози в еритрозо-4-фосфат. Цей чотиривуглецевий субстрат конденсується під дією синтази з фосфоенол-піруватом щоб отримати семивуглецевий 3-деокси-D-арабіно-гептулозонат-7-фосфат (DAHP)[en]. На двох наступних стадіях, що включають синтазу дегідрохінової кислоти та дегідрогеназу, і отримують сполуку.[4]
Похідні біциклічних лактонів називають хінідами. Одним із прикладів є 4-кафеоїл-1,5-хінід.
Дегідрування та окиснення хінної кислоти дає галову кислоту.[4]
Хінна кислота використовується як засіб, що поєднує тканини[en].
Ця кислота є універсальним хіральним вихідним матеріалом для синтезу фармацевтичних препаратів.[4] Вона є важливою речовиною у синтезі озельтамівіру, який використовується для лікування грипу А і В.
- ↑ Santos, Sónia A. O.; Freire, Carmen S. R.; Domingues, M. Rosário M.; Silvestre, Armando J. D.; Neto, Carlos Pascoal (2011). Characterization of Phenolic Components in Polar Extracts of Eucalyptus globulus Labill. Bark by High-Performance Liquid Chromatography–Mass Spectrometry. Journal of Agricultural and Food Chemistry. 59 (17): 9386—93. doi:10.1021/jf201801q. PMID 21761864.
- ↑ Hofmann: Crell's chemische Annal. 1790, II, p. 314, cited in S. Baup: Über die Chinasäure und einige ihrer Verbindungen. In: Annalen der Physik und Chemie 1833, p. 64–70 (, p. 64, at Google Books).
- ↑ Lautemann, E. (1863) «Ueber die Reduction der Chinasäure zu Benzoësäure und die Verwandlung derselben in Hippursäure im thierischen Organismus» (On the reduction of quinic acid to benzoic acid and its transformation into hippuric acid in the animal organism), Annalen der Chemie, 125 : 9–13.
- ↑ а б в Barco, Achille; Benetti, Simonetta; De Risi, Carmela; Marchetti, Paolo; Pollini, Gian P.; Zanirato, Vinicio (1997). D(-)-Quinic Acid: a Chiron Store for Natural Product Synthesis. Tetrahedron: Asymmetry. 8: 3515—3545. doi:10.1016/S0957-4166(97)00471-0.
- Quinic acid - chiral compounds from nature - Buchler quinine plant in Braunschweig,Germany. Quinic acid. Процитовано 5 вересня 2005.
- Quinic acid. Fast Health. Процитовано 5 вересня 2005.
- History of Xenobiotic Metabolism. Архів оригіналу за 12 квітня 2005. Процитовано 5 вересня 2005.
 Ripley, George; Dana, Charles A., ред. (1879). . // The American Cyclopædia.
Ripley, George; Dana, Charles A., ред. (1879). . // The American Cyclopædia.

