2-Нафтол
| Структурна формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Загальна інформація | ||||||||||||||||
| Преференційна назва ІЮПАК | ||||||||||||||||
| Систематична назва ІЮПАК | Нафтален-2-ол | |||||||||||||||
| Інші назви |
2-Нафтол, Бета-нафтол, 2-гідроксинафтален | |||||||||||||||
| Хімічна формула | C10H8O | |||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення
| |||||||||||||||
| Зовнішні ідентифікатори / Бази даних | ||||||||||||||||
| ||||||||||||||||
| Властивості | ||||||||||||||||
| Молярна маса | 144,057515 г/моль | |||||||||||||||
| Агрегатний стан |
Твердий | |||||||||||||||
| Зовнішній вигляд |
білі кристали | |||||||||||||||
| Густина |
1.28 г/см³ (20 °C) | |||||||||||||||
| Температура плавлення |
121,6 - 123,0 °C | |||||||||||||||
| Температура кипіння |
285,0 °C | |||||||||||||||
| Температура самозаймання |
550 °C | |||||||||||||||
| Тиск насиченої пари |
2 Па (25 °C) | |||||||||||||||
| pKa |
9,51 (25 °C) | |||||||||||||||
| Розчинність |
0,074 г/100 мл (вода, 25 °C) | |||||||||||||||
| Дипольний момент |
5,13 * 1030 Кл*м (бензен, 25 °C) | |||||||||||||||
| Безпека | ||||||||||||||||
| Маркування згідно системі УГС
Увага | ||||||||||||||||
| H-фрази | H: H302, H332, H400 | |||||||||||||||
| P-фрази | P: P261, P264, P270, P271, P273, P301+P312, P304+P312, P304+P340, P312, P330, P391, P501 | |||||||||||||||
| LD50 |
1960 мг/кг (щур, орально) | |||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | ||||||||||||||||
2-Нафтол (β-нафтол) — органічна сполука з формулою із класу фенолів. Є похідною нафталену, в якій атом H у β-позиції заміщений на гідроксильну групу. Ізомер 1-нафтолу.
Міститься в кам'яновугільній смолі в маленьких кількостях.[1]

2-Нафтол має вигляд білої твердої речовини. Під дією повітря і світла темнішає. Запах — слабкий фенольний. Дуже добре розчиняється в етанолі та діетиловому етері, трохи гірше — в бензені та хлороформі. У воді розчиняється дуже погано[2].
2-Нафтол отримують лужним сплавленням 2-нафталенсульфокислоти:[3]
Спочатку натрієву сіль кислоти поступово додають до 50 % розчину натрій гідроксиду при температурі 300 °C, далі нагрівають до 320 °C. Після завершення реакції розплав виливають в воду, додають розведену сульфатну кислоту до рН 8 при температурі більше 100 °C, 2-нафтол у рідкому вигляді відділяють і вакуум-дистилюють. Загальний вихід складає 70 %, починаючи з нафталену.[3]
Також отримують окисненням 2-ізопропілнафталену, який отримують ізомеризацією 1-ізопропілнафталену. Спочатку утворюється гідропероксид, який далі розпадається на 2-нафтол та ацетон[3]:
Реакції алкілювання та ізомеризація проводять в присутності фосфатної кислоти при температурі до 240 °C. Окиснення 2-ізопропілнафталену до гідропероксиду проводять при температурі 90—110 °С в присутності каталізатору. Розщеплюється гідропероксид за допомогою розведеної сульфатної кислоти.[3]
Ще один спосіб отримання 2-нафтолу — гідроліз 2-хлоронафталіну.[1]
Гідроксильна група має кислотні властивості. Може взаємодіяти з лугами, утворюючи солі[4]:
При взаємодії зі спиртами утворює етери, а з ангідридами чи хлороангідридами карбонових кислот — естери[4]:
- (X = Cl, O-CO-R)
При взаємодії з диметилтіокарбамілхлоридом в лужному середовищі утворюється 2-нафтилдиметилтіокарбамат, з якого потім можна отримати 2-нафталентіол:[5]
Реакція з фосфор пентахлоридом при відносно низькій температурі утворює три-2-нафтилфосфат, а при 150 °C продуктом є 2-хлоронафтален.[3]
При реакції з аміаком в присутності гідросульфіту натрію відбувається реакція Бухерера і утворюється 2-нафтиламін:[1]
Аналогічно, реакція з аніліном веде до утворення 2-нафтилфеніламіну.[3]
Легко вступає в реакції електрофільного заміщення.
При хлоруванні гіпохлоритом натрію утворюється 1-хлоро-2-нафтол. При застосуванні сульфурил хлориду (SO2Cl2) може утворитися 1,4-дихлоро-2-нафтол. А розчин хлору в натрій карбонаті утворює 8-хлоро-2-нафтол.[3][4]
При бромуванні в оцтовій кислоті утоврюється 1-бромо-2-нафтол, за наявності більшої кількості брому утворюється 1,6-дибромо-2-нафтол, який може дебромуватися в присутності розведеної кислоти, утворюючи 6-бромо-2-нафтол. При надлишку брому і температурі 100 °C утворюється 1,5,6-трибромо-2-нафтол, а також 1,3,5,6-тетрабромо-2-нафтол.[3]
Сульфування при 0 °C веде до утворення 3-гідроксинафтален-1-сульфокислоти, тобто сульфогрупа вступає в мета-положення до гідроксигрупи.[4]
Реагує з діоксидом азоту (нітрування) з утворенням 1-нітро-2-нафтолу. Оскільки нітрогрупа — дезактувуючий замісник, друга нітрогрупа вступає в інше кільце, утворюючи 1,6-динітро-2-нафтол. При застовуванні концентрованого розчину нітратної кислоти в оцтовій кислоті одразу утворюється 1,6-динітро-2-нафтол.[3][4]
Також вступає у реакції азосполучення в положення 1[4].
При окисненні хлоридом феруму(III) утворюється 2,2'-дигідрокси-1,1'-бінафтил[3]:
Може відновлюватися воднем у присутності каталізатору чи натрієм. При цьому утворюється переважно 1,2,3,4-тетрагідро-2-нафтол.[3]
Застосовується для отримання азобарвників, таких як Судан, Кислотний помаранчевий 7.
-
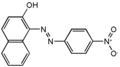
Кислотний помаранчевий 7
-
Судан I
-
Судан II
-
Пара червоний
Метилові та етилові етери нафтолу застосовуються для виготовлення ліків. Продукт реакції з хлороцтовою кислотою, 2-нафтоксиоцтова кислота, є стимулятором росту фруктів, а 2-гідроксиетиловий етер 2-нафтолу —заспокійливе для тварин.[3]
2-Нафтол токсичний. Подразнює шкіру і дихальні шляхи, пошкоджує кров та нирки. При довготривалому впливі пошкоджує печінку, кров, нервову систему, травний тракт. Про репродуктивну токсичність та канцерогенність невідомо.[6]
- ↑ а б в НАФТОЛЫ • Большая российская энциклопедия - электронная версия. bigenc.ru. Архів оригіналу за 21 січня 2021. Процитовано 7 квітня 2021. [Архівовано 2021-01-21 у Wayback Machine.]
- ↑ PubChem. 2-Naphthol. pubchem.ncbi.nlm.nih.gov (англ.). Архів оригіналу за 18 листопада 2020. Процитовано 3 листопада 2020.
- ↑ а б в г д е ж и к л м н Booth, Gerald (15 червня 2000). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Naphthalene Derivatives. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a17_009. doi:10.1002/14356007.a17_009. ISBN 978-3-527-30673-2.
- ↑ а б в г д е Нафтолы // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Большая Рос. энцикл., 1992. — Т. 3 : Меди сульфиды — Полимерные красители. — Стб. 387. — Библиогр. в конце ст. — ISBN 5-85270-039-8.(рос.)
- ↑ THIOPHENOLS FROM PHENOLS: 2-NAPHTHALENETHIOL. Organic Syntheses. Т. 51. 1971. с. 139. doi:10.15227/orgsyn.051.0139. Архів оригіналу за 2 жовтня 2020. Процитовано 7 квітня 2021.
- ↑ GESTIS Substance Database. gestis-database.dguv.de. Процитовано 7 квітня 2021.







![{\displaystyle {\ce {C10H7-OH + R-OH <=> [H^+]C10H7-OR + H_2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cc637897751fc826e9dda6b84a7877bc06c5ef9)

![{\displaystyle {\ce {C10H7-OH + Cl-CS-N(CH3)2 -> [OH^-]C10H7-O-CS-N(CH3)2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8b50a1fe6f8df5e347d37751fcbd078780e4bce)