Аморфні речовини
| Нерозв'язані проблеми фізики: Яка природа переходу між рідкою або звичайною кристалічною і склоподібною фазами? Які фізичні процеси приводять до основних властивостей скла?
(більше нерозв'язаних проблем фізики) |
Амо́рфні речови́ни — це тверді речовини, які не мають дального порядку в розташуванні частинок (атомів, молекул, йонів) і не утворюють кристалічних ґраток, однак ближній порядок в таких речовинах існує.
Прикладами аморфних речовин є скло, пластмаса, смола, каніфоль, бурштин та пластична сірка. Деякі речовини можуть перебувати як в аморфному, так і в кристалічному стані, наприклад, сірка.
Аморфні речовини утворюються за швидкого охолодження розплавів, під час якого атоми не встигають сформувати дальній порядок, чи за конденсації з газу.
Аморфні речовини не мають чітко визначеної температури плавлення. За нагрівання вони розм'якають, перетворюючись на в'язку рідину.
Загалом, аморфні тіла є порівняно менш вивченими за інші стани матерії, тому описані в цій статті закони і властивості здебільшого є емпіричними і можуть мати винятки.

Властивості аморфних речовин є проміжними між рідинами і кристалічними твердими тілами.
Як і рідинам, речовинам в аморфному стані властивий ближній порядок: існують закономірності розташування молекул одна відносно одної як геометричні (координаційне число), так і хімічні (атоми одного сорту розташовуються поруч з атомами іншого сорту), проте ці закономірності зберігаються лише для невеликих відстаней. У випадку більшості аморфних речовин це відстань від 0,5 до 5 нанометрів[2].
Як і у твердих тілах окремі атоми і молекули аморфних тіл мають надзвичайно низьку рухливість. Завдяки цьому аморфні речовини зберігають свою форму і розмір.
Таким чином, з одного боку, аморфний стан можна сприймати як полікристал, розмір зерен якого становить лише кілька атомів[3], а з іншого — як рідину з надзвичайно великою в'язкістю (1013 П і вище[4]). Варто зазначити, що порівняння аморфних тіл з рідиною не є точним, оскільки рівняння, що описують поведінку аморфних тіл (наприклад, залежність їх об'єму від температури або реакцію на деформацію) принципово відрізняються від аналогічних рівнянь для в'язких рідин. Аморфні тіла отримують сильно виражені неньютонівські властивості, яких не мала рідина до охолодження.
Одні й ті самі речовини можуть тверднути як у кристалічну, так і в аморфну форму в залежності від режиму охолодження.
Атоми і молекули у аморфних тілах не знаходяться у положеннях мінімуму потенціальної енергії, тому аморфний стан є метастабільним і з часом прагне кристалізуватися, проте процес кристалізації за кімнатної температури може тривати багато років, століть чи навіть тисячоліть. Перехід у кристалічну форму не є обов'язковим етапом для всіх аморфних тіл: найстаріший знайдений бурштин має вік 320 мільйонів років і залишається аморфним. Обсидіан (натуральне скло) рідко існує більш ніж кілька мільйонів років — проте впродовж цього часу тенденція до кристалізації у ньому не спостерігається[5].
Деякі режими охолодження породжують тіла у змішаному стані, за якого кристали розміром у кілька нанометрів розділені прошарками аморфної фази[6].
Хаотична будова призводить до швидкого розсіяння квазічастинок, таких як фонони, через що теплопровідність аморфних тіл є, зазвичай, нижчою ніж у кристалів[7].
У деяких речовин, наприклад, вуглецю, у аморфному стані можуть зникати гібридизовані орбіталі[8].
Через відсутність дальнього порядку злам аморфного тіла часто складається з хаотично розташованих округлих форм, тоді як злам кристалу проходить площинами спайності.
На відміну від рідин аморфні тіла проявляють опір за деформацій зсуву[9].
Аморфні метали мають значно вищу границю міцності[10] — їх відносне видовження може досягати кількох відсотків до руйнування.
Модуль Юнга аморфних тіл сильно залежить від температури, а також від того, як повільно тіло розтягується — чим повільніше зростає сила, тим нижчим є модуль пружності[10]. За достатньо повільних деформацій багато аморфних тіл можна вважати плинними.
Міцність і корозієстійкість аморфних металів також є вищими ніж у кристалічних, ймовірно, через відсутність дефектів ґратки[11].
Можна виділити кілька великих груп аморфних речовин: скло, пластик, гелі. Границі цих груп не є чітко визначеними, наприклад, існує органічне скло, що також є пластиком. Часто аморфні речовини класифікують за методами отримання. У такому випадку «склом» називають аморфні тіла, що отримують охолодженням розплаву. Іноді термін «скло» використовують як синонім до «тіла в аморфному стані».
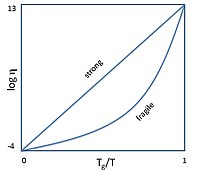
Склоподібні аморфні тіла утворюються з переохолодженої рідини. За охолодження в'язкість рідини збільшується. Температурою склування називають таку температуру, за якої в'язкість досягає 1013 П (в квадрильйон разів більше ніж в'язкість води). Згідно з емпіричним правилом, температура склування дорівнює приблизно 2/3 від температури плавлення[12]. Якщо рідину вдалося переохолодити до такої температури, не допустивши початку кристалізації, перехід до кристалічного стану стає надзвичайно повільним або ж неможливим, оскільки швидкість переміщення атомів і молекул у тілі також зменшується у трильйони разів.
Існує кілька рівнянь, що описують зростання в'язкості переохолоджених рідин.
В'язкість звичайних рідин за високої температури добре описується законом Арреніуса:
- ,
де і — константи що визначаються конкретною речовиною.
В'язкість деяких переохолоджених рідин описується іншим рівнянням, емпіричним законом Фогеля-Фулчера-Тамманна[en]:
- ,
де — температура, що зазвичай приблизно на 50 К нижча за температуру склування[13]. Через цю зміну за переохолодження в'язкість рідини різко зростає лише за досягнення температури склування.
Причини переходу для деяких речовин від закону Арреніуса до закону Фогеля-Фулчера-Тамманна не до кінця зрозумілі.
Скло, в'язкість якого змінюється за законом Арреніуса, називають міцним. Скло, в'язкість якого зростає за законом Фогеля-Фулчера-Тамманна називають крихким. На діаграмі Енжела[en] міцне скло за охолодження рухаються вгору вздовж прямої, а крихке — вздовж опуклої траєкторії. Ступінь опуклості цієї траєкторії називається крихкістю скла[en]. У деяких випадках траєкторія охолодження на діаграмі Енжела є ще більш складною[14]. Варто зазначити, що «крихкість» і «міцність» в даному випадку ніяк не стосується механічних властивостей стекол.
Найбільш класичні приклади стекол — оксиди напівметалів, таких як кремній і германій. Такі стекла відносяться до міцних. Прикладом крихкого скла може бути толуен.
Стекла є дуже розповсюдженими і за властивостями максимально подібні до твердих тіл. Існує розповсюджена помилка, що стекла у вікнах поступово «стікають» вниз, через що нижні частини старовинних вітражів є товстішими за верхні. Насправді, різниця в товщині пояснюється технологічними процесами середньовіччя. В'язкість звичайного скла за кімнатної температури становить 1018 П. Експерименти показали, що за 6 років віконне скло деформується лише на 1 нанометр[15]. Для зміни товщини скла на 10 % знадобилося б більше мільйона років.
Полімери складаються з довгих молекул. У випадку, якщо вони не згорнуті у глобули, а існують у вільному стані, то зазвичай вони сильно і хаотично переплетені і через свої величезні розміри розплутати, їх щоб вбудувати в кристалічну ґратку, дуже важко. З іншого боку, завдяки великим розмірам молекул, полімерні аморфні тіла мають деякі незвичайні властивості.
Полімери можуть існувати у особливому високоеластичному стані[en]. Температурний діапазон цього стану лежить між твердим склоподібним і плавленням. Його особливістю є те, що сегменти Куна кожної молекули можуть доволі швидко обертатися (час обертання є меншим за 1 секунду), завдяки чому ланцюги полімерних молекул можуть порівняно вільно ковзати вздовж один одного, хоч і не можуть відриватися. На макрорівні це призводить до надзвичайно великої еластичності таких тіл — вони можуть розтягуватися у десятки разів при невеликих прикладених силах. Тіла, що знаходяться у високоеластичному стані за кімнатної температури, називаються гумами[16].
У аморфному полімерному тілі можуть існувати окремі зони, де ланцюги молекул складаються у кристалічну ґратку. У таких нанокристалах не обов'язково задіяні цілі молекули. Якщо таких кристалічних регіонів стає достатньо багато, то весь об'єм матеріалу стає твердим, не зважаючи на те, що значна його частина все ще знаходиться в аморфному стані[16].
Гелем називають дисперсну систему, у якій дисперсна фаза утворює нерегулярну ґратку, що утримує всю систему у стабільному стані, підтримуючи її форму і надаючи пружності. Дисперсійне середовище за цього лишається рідким. Гелями є багато побутових аморфних тіл, в першу чергу їжа (сири, желе, майонез) і косметика (зубна паста, піна для гоління)[17].
Аморфні тіла мають кілька особливостей, що відрізняють їх від кристалічних тіл. По-перше, на відміну від кристалів, у яких валентна зона і зона провідності мають чіткі границі, у аморфних тілах густина станів змінюється плавно, тому можна казати лише про зони малої густини і зони великої густини. Відповідно, у аморфних тілах не існує поверхні Фермі і зони Бріллюена[18].
Друга відмінність полягає в тому, що у аморфному тілі стани значної частини електронів локалізовані у просторі, тоді як у кристалах вони розподілені по всьому простору кристала[18]. У делокалізованому стані
- ,
тобто, якщо почекати достатньо довго, то хвильова функція електрона рівномірно заповнить весь простір кристала.
Для локалізованих електронів густину ймовірності знайти електрон на відстані R від початкової точки після достатньо довгого часу можна записати як:
- ,
де L — довжина локалізації. Такий стан називається локалізацією Андерсона[19].
За зростання енергії електронів їх довжина локалізації зростає і за досягнення деякого рівня, що називається порогом рухливості, електрони переходять у делокалізований стан.
У аморфних тіл, рівень Фермі яких знаходиться нижче порога рухливості за температури 0 К рухливість носіїв заряду є нульовою, а за ненульової температури для них характерна стрибкова провідність: електрони з деякою ймовірністю можуть перескочити з одного локалізованого стану в інший. Інтенсивність таких переходів сильно залежить від температури.
У термінах зонної теорії можна сказати, що у аморфних тілах заборонена зона заповнена дискретними рівнями, хоча густина станів у ній є невисокою, а також, на відміну від кристалічних тіл, електрони не можуть вільно переходити з одного рівня на інший, але додатково обмежені локалізацією — можливі лише переходи між рівнями, що фізично знаходяться один поруч з іншим. Така специфічна зона називається щілиною рухливості[20].
У випадку, якщо рівень Фермі лежить вище порогу рухливості, аморфне тіло є провідником.
Аморфні метали, загалом, схожі за властивостями до стекол, і часто відносяться до них. Особливістю металів є те, що для отримання їх переохолодженням розплаву необхідні надзвичайно великі швидкості охолодження, до 1012 К/с[12]. Для цього використовують спеціальні методи, такі як вакуумне напилення, введення дефектів ґратки у кристал, гартування на диску[21].
Привести в аморфний стан сплави, загалом, простіше ніж чисті метали - для цього потрібна швидкість охолодження від сотень до десятків тисяч кельвінів на секунду[22].
Ділянки аморфної фази утворюються у деяких сплавах за сильних деформацій зсуву[23].
Аморфні метали є провідниками, проте їх опір зазвичай є вищим, ніж у аналогічних металів у кристалічному стані[24].
На відміну від звичайних стекол, які за нагрівання розм'якають, аморфні метали за нагрівання кристалізуються за температури 0,4-0,6 від точки плавлення[25].

Напівпровідники також можуть перебувати в аморфному стані. Такі системи отримують як охолодженням розплаву (напівпровідники на основі селену, телуру, сульфідів металів), так і вакуумним напиленням (аморфний кремній і германій).
Для аморфних напівпровідників звичайний механізм домішкової провідності майже не працює, оскільки завдяки хаотичній структурі домішки легко формують кількість зв'язків, що відповідає їх валентності, і не утворюють «зайвих» електронів або дірок. Втім, допування перехідними металами, такими як вольфрам, залізо і молібден створює такі електрони, ймовірно, через те що електрони d-орбіталі не беруть участі у ковалентних зв'язках[26].
У аморфних провідниках часто спостерігається ефект перемикання, за якого провідність різко зростає у зовнішньому електричному полі (за різниці потенйціалів понад 107 В/м[26].
У деяких аморфних тіл (особливо це стосується прозорих тіл) заборонена зона все ж існує, тобто, є діапазон енергій, густина станів у якому тотожно дорівнює нулю[27]. Такі тіла практично не проводять струм. Аморфні діелектрики мають, зазвичай, меншу густину ніж кристалічні, тому їх діелектрична проникність також є порівняно нижчою[28].
- ↑ Kucherov, Olexandr; Mudryk, Andrey (2023). Picoscopy Discoveries of the Binary Atomic Structure. Applied Functional Materials AFM. 3 (2): 1—7.
- ↑ аморфное состояние [Архівовано 11 квітня 2021 у Wayback Machine.](рос.)
- ↑ Atomic Scale Structure of Materials [Архівовано 14 квітня 2021 у Wayback Machine.](англ.)
- ↑ of glass(англ.)
- ↑ Glass Transition, Crystallization of Glass-Forming Melts, and Entropy. Архів оригіналу за 18 вересня 2020. Процитовано 6 лютого 2021.
- ↑ Аморфные и нанокристаллические структуры: сходства, различия, взаимные переходы [Архівовано 21 січня 2022 у Wayback Machine.](рос.)
- ↑ Thermal Conductivity of Amorphous Materials [Архівовано 10 серпня 2021 у Wayback Machine.](англ.)
- ↑ Kucherov, Olexandr (2021). Direct Visualization of Covalent Chemical Bonds in Crystalline Silicon (PDF). American Journal of Engineering Research (AJER). 10 (6): 54—58.
- ↑ Amorphous solid [Архівовано 21 квітня 2021 у Wayback Machine.](англ.)
- ↑ а б Mechanical Characteristics of Amorphous Metals [Архівовано 10 серпня 2021 у Wayback Machine.](англ.)
- ↑ Аморфные металлы [Архівовано 11 квітня 2021 у Wayback Machine.](рос.)
- ↑ а б Судзуки,Фудзимори,Хасимото, 1987, с. 61.
- ↑ Arrhenius-type temperature dependence of thesegmental relaxation below T g [Архівовано 8 листопада 2020 у Wayback Machine.](англ.)
- ↑ Fragile-to-strong transitions in glass forming liquids [Архівовано 29 листопада 2020 у Wayback Machine.](англ.)
- ↑ Relaxation time and viscosity of fused silica glass at room temperature [Архівовано 8 березня 2021 у Wayback Machine.](англ.)
- ↑ а б Glass, rubber and melt phase [Архівовано 10 квітня 2021 у Wayback Machine.](англ.)
- ↑ Weak and Strong Gels and the Emergence of the Amorphous Solid State
- ↑ а б Павлов,Хохлов, 2000, с. 459.
- ↑ андерсоновская локализация [Архівовано 11 квітня 2021 у Wayback Machine.](рос.)
- ↑ Павлов,Хохлов, 2000, с. 462.
- ↑ Судзуки,Фудзимори,Хасимото, 1987, с. 30.
- ↑ Судзуки,Фудзимори,Хасимото, 1987, с. 60.
- ↑ Экстремальные нагрузки вызвали появление аморфных фаз в высокоэнтропийном сплаве [Архівовано 3 лютого 2021 у Wayback Machine.](рос.)
- ↑ Судзуки,Фудзимори,Хасимото, 1987, с. 197.
- ↑ Павлов,Хохлов, 2000, с. 477.
- ↑ а б аморфные и стеклообразные полупроводники [Архівовано 12 квітня 2021 у Wayback Machine.](англ.)
- ↑ Павлов,Хохлов, 2000, с. 461.
- ↑ Павлов,Хохлов, 2000, с. 476.
- І. М. Кучерук, І. Т. Горбачук, П. П. Луцик (2006). Загальний курс фізики: Навчальний посібник у 3-х т. Київ: Техніка.
- Судзуки К., Фудзимори Х., Хасимото К. Аморфные металлы. — М. : «Металлургия», 1987. — 328 с.
- П.В. Павлов, А.Ф. Хохлов. Физика твёрдого тела. — М. : «Высшая школа», 2000. — 494 с. — ISBN 5-06-003770-3.












