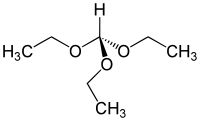
Триетилортоформіат
| Структурна формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Загальна інформація | ||||||||||||||||
| Преференційна назва ІЮПАК | Діетоксиметоксиетан | |||||||||||||||
| Систематична назва ІЮПАК | Діетоксиметоксиетан | |||||||||||||||
| Інші назви |
Триетилортоформіат, триетоксиметан, етилортоформіат, триетилортоформіат, етиловий ефір ортомурашиної кислоти | |||||||||||||||
| Хімічна формула | C7H16O3 | |||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | |||||||||||||||
| Зовнішні ідентифікатори / Бази даних | ||||||||||||||||
| ||||||||||||||||
| Властивості | ||||||||||||||||
| Молярна маса | 148,20 г/моль | |||||||||||||||
| Агрегатний стан |
Рідина | |||||||||||||||
| Густина |
0,895 г / см 3 (20 °C) | |||||||||||||||
| Температура плавлення |
-76,1 °С | |||||||||||||||
| Температура кипіння |
143,0 - 146°C | |||||||||||||||
| Температура самозаймання |
188 °С | |||||||||||||||
| Розчинність |
1,35 г/л (вода, 20 °С) | |||||||||||||||
| Безпека | ||||||||||||||||
| Маркування згідно системі УГС
Небезпека | ||||||||||||||||
| H-фрази | H: H226 | |||||||||||||||
| P-фрази | P: P210 | |||||||||||||||
| EUH-фрази | EUH: | |||||||||||||||
| LD50 |
7060 мг/кг (щур, орально) | |||||||||||||||
| LC50 |
17800 мг/кг (кролик, шкірно) | |||||||||||||||
| Вибухонебезпечність | ||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | ||||||||||||||||
Триметилортоформіат[1] — органічна сполука з класу ортоестерів, похідна ортомурашиної кислоти HC(OH)3 (яка не існує у вільному вигляді) та етилового спирту. За звичайних умов — безбарвна рідина з різким запахом.[2] Отримують за реакцією Вільямсона між хлороформом та етоксидом натрію:[3]
Застосовується для отримання альдегідів з реактивів Гріньяра за реакцією Бодру-Чичибабина:[4]
Також застосовується для перетворення карбонових кислот на естери.[5] Окрім цього, триетилортоформіат застосовується як зневоднюючий агент при утворенні комплексів іонів металів з етанолом, наприклад[6]:
- ↑ Ю.О.Ластухін. Хімія природних орrанічних сполук: Навч. посібник. — Львів: НУ "Львівська політехніка", 2005. - 560 с. ISBN 966-7597-47-4 (С.101)
- ↑ PubChem. Triethyl orthoformate. pubchem.ncbi.nlm.nih.gov (англ.). Архів оригіналу за 21 січня 2022. Процитовано 5 червня 2021.
- ↑ Organic Syntheses Procedure. orgsyn.org (англ.). Архів оригіналу за 5 червня 2021. Процитовано 5 червня 2021.
- ↑ Organic Syntheses Procedure. orgsyn.org (англ.). Архів оригіналу за 5 червня 2021. Процитовано 5 червня 2021.
- ↑ Paine, John B. (1 липня 2008). Esters of Pyromellitic Acid. Part I. Esters of Achiral Alcohols: Regioselective Synthesis of Partial and Mixed Pyromellitate Esters, Mechanism of Transesterification in the Quantitative Esterification of the Pyromellitate System Using Orthoformate Esters, and a Facile Synthesis of the Ortho Pyromellitate Diester Substitution Pattern. The Journal of Organic Chemistry (англ.). Т. 73, № 13. с. 4929—4938. doi:10.1021/jo800543w. ISSN 0022-3263. Архів оригіналу за 5 червня 2021. Процитовано 5 червня 2021.
- ↑ Driessen, Willem L.; Reedijk, Jan; Dunbar, Kim R.; Pence, Laura E. (5 січня 2007). Grimes, Russell N. (ред.). Solid Solvates: The Use of Weak Ligands in Coordination Chemistry. Inorganic Syntheses. Hoboken, NJ, USA: John Wiley & Sons, Inc. с. 111—118. doi:10.1002/9780470132609.ch27. ISBN 978-0-470-13260-9.



2 + 6 HC(OC2H5)3 -> [Ni(C2H5OH)6](BF4)2 + 6 HC(O)(OC2H5) + 6 HOC2H5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e260b013f4735369b2fe1a71e6f763c289c23c7)