2-Меркаптоетанол
| 2-меркаптоетанол | |
|---|---|
 2-меркаптоетанол
| |
 2-Mercaptoethanol
| |
| Назва за IUPAC | 2-гідрокси-1-етантіол |
| Інші назви | 2-меркаптоетанол тіогліколь β-меркаптоетанол |
| Ідентифікатори | |
| Абревіатури | BME, 2BME, або β-met |
| Номер CAS | 60-24-2 |
| Номер EINECS | 200-464-6 |
| DrugBank | DB03345 |
| KEGG | C00928 |
| Назва MeSH | D02.033.375.534 і D02.886.489.409 |
| ChEBI | 41218 |
| RTECS | KL5600000 |
| SMILES | OCCS |
| InChI | 1/C2H6OS/c3-1-2-4/h3-4H,1-2H2 |
| Номер Бельштейна | 773648 |
| Номер Гмеліна | 1368 |
| Властивості | |
| Молекулярна формула | C2H6OS |
| Молярна маса | 78,133±0,007 г моль−1 |
| Зовнішній вигляд | рідина без кольору із характерним запахом |
| Густина | 1,11 г см−3 |
| Тпл | −100 °C |
| Ткип | 157-158 °C |
| Розчинність (вода) | змішуваний |
| Тиск насиченої пари | 0,13 кПа за t=20°C |
| Показник заломлення (nD) | 1,4996 |
| Небезпеки | |
| MSDS | Oxford MSDS |
| Класифікація ЄС | |
| R-фрази | R23 R24 R25 R37 R38 R41 |
| S-фрази | S26 S36 S37 S39 S45 S53 |
| Пов'язані речовини | |
| Пов'язані речовини | етиленгліколь 1,2-етандитіол |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
2-Меркаптоетано́л (також β-меркаптоетано́л, βME, 2βME, або β-met) — хімічна сполука з формулою HOCH2CH2SH. Є гібридом етиленгліколю (HOCH2CH2OH) й 1,2-етандитіолу (HSCH2CH2SH).
МЕ або βМЕ, як часто скорочують, використовують для послаблення дисульфідного зв'язку. 2-меркаптоетанол може діяти як біологічний антиоксидант, утилізуючи гідроксильні радикали (серед інших).
МЕ широко застосовується, позаяк гідроксильна група робить молекулу розчинною у воді та зменшує леткість.
Завдяки послабленому тискові насиченої пари, запах, хоча й неприємний, менш жахливий, ніж у решти меркаптанів.
2-Меркаптоетанол можна отримати, діючи сірководнем на оксиран:[1]
2-Меркаптоетанол реагує з альдегідами і кетонами з утворенням відповідних оксатіоланів. Тому 2-меркаптоетанол часто використовують як захисну групу[2].
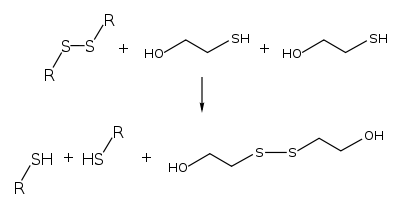
Деякі протеїни можна денатурувати 2-меркаптоетанолом через його здатність розщеплювати дисульфідний зв'язок. Так, цистин денатурується до цистеїну:
Через розривання S-S зв'язків, і третинна, і четвертинна структури деяких білків можуть бути зруйновані[3]. Завдяки своїй здатності руйнувати структуру білків, 2-меркаптоетанол використовувався для аналізу білків, наприклад, для того, щоб отримати розчин білків, який містить саме мономерні молекули білка, а не димери або олігомери вищого порядку з дисульфідними зв'язками. Однак, оскільки 2-меркаптоетанол утворює адукти з вільним цистеїном та є токсичною речовиною з неприємним запахом, в даний час замість нього використовують сильніший відновник — дитіотреїтол (DTT), перш за все в SDS-PAGE.
Також замість 2-Меркаптоетанолу та дитіотреїтолу (DTT) у біологічних цілях може використовуватись три-(2-карбоксиетил)фосфін.
2-Меркаптоетанол використовується в деяких процедурах виділення РНК для зменшення виділення рибонуклеази під час лізису клітин. Через велику кількість дисульфідних зв'язків рибонуклеази є дуже стабільними ферментами, тому 2-меркаптоетанол використовується для відновлення цих дисульфідних зв'язків і необоротної денатурації білків. Це запобігає споживанню РНК під час її виділення[4].
2-Меркаптоетанол вважається токсином, який спричиняє хворобливе подразнення назальних проходів і дихального тракту через вдихання, подразнення на шкірі, нудоту й біль у шлунку через ковтання, та потенційно смерть за жорсткого впливу (експозиції).[5]
- ↑ Knight, J.J. Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289. Article «2-Mercaptoethanol».
- ↑ 1,3-Dithiolanes, 1,3-Dithianes. Organic Chemistry Portal. Архів оригіналу за 8 липня 2013. Процитовано 29 липня 2018.
- ↑ 2-Mercaptoethanol. Chemicalland21.com. Архів оригіналу за 8 липня 2013. Процитовано 5 жовтня 2010.
- ↑ Nelson, David R.; Lehninger, Albert L; Cox, Michael (2005). Lehninger principles of biochemistry. New York: W.H. Freeman. с. 148. ISBN 0-7167-4339-6.
- ↑ Material Safety Data Sheet. JT Baker. Архів оригіналу за 8 липня 2013. Процитовано 5 жовтня 2010.